Разность - электроотрицательность
Cтраница 2
 |
Относительная электроотрицательность некоторых элементов ( по Полингу. [16] |
Между разностью электроотрицательностей взаимодействующих атомов и сдвигом электронного облака существует прямая зависимость. [17]
 |
Абсолютная жесткость и абсолютная электроотрицательность молекул. [18] |
По смыслу разность электроотрицательностей представляет собой термодинамическую движущую силу переноса заряда от основания к кислоте, а сумма абсолютных жесткостей является мерой сопротивления молекул А и В переносу заряда, т.е. связана с их поляризуемостью. [19]
Чем больше разность электроотрицательностей соединяющихся атомов, тем более полярна связь. Наиболее полярной является связь Н - Li. [20]
Чем больше разность электроотрицательностей отдельных атомов, тем больше и степень ионности образующейся связи, которую обычно оценивают в процентах. [21]
 |
Зависимость степени ионности связи Р от разности электроотрицатель-ностей х элементов по Полингу. [22] |
С увеличением разности электроотрицательностей элементов растет степень ионности связи. [23]
Зависимость между разностями электроотрицательностей и долей электростатической связи приближенно дана на фиг. Так, например, для связи Si-О из разности электроотрицательностей, равной 1 7, можно установить примерно 50 % ионной связи. [24]
АХ - мера разности электроотрицательностей исследуемого и стандартного заместителей; 7 - та же константа пропорциональности, что и в уравнении ( 65) для незаряженных групп ( лучше согласующаяся с константой alt чем с а); де - величина, пропорциональная электронному заряду заместителя. [25]
Величина АЕ зависит от разности электроотрицательностей х элементов. [26]
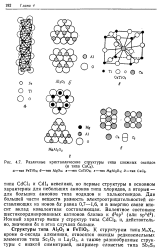 |
Различные кристаллические структуры типа сложных оксидов. [27] |
Для большей части веществ разность электроотрицательностей составляющих их ионов дх равна 0 7 - 1 6, и в энергию связи вносит вклад ковалентная составляющая. Ионный характер выше у структур типа CdCU, и, действительно, значения 8х в этих случаях больше. [28]
 |
Элементарная ячейка кристалла фторида кальция ( структурный тип флюорита. [29] |
Поскольку при таком замещении разность электроотрицательностей компонентов возрастает, соответствующие бинарные соединения обладают солеобразным характером и структурами, свойственными преимущественно ионной связи. Однако в этих случаях координационные числа катионо - и анионообразователей должны быть разными - обратно пропорциональными числу атомов в формульной единице. Некоторые из этих соединений обладают более сложными структурами псевдомолекулярного типа, когда разность ОЭО компонентов недостаточно велика для образования ионных кристаллов. [30]
Страницы: 1 2 3 4