Разрушение - комплексный ион
Cтраница 2
Комплексный ион [ Ag ( NH3) 2J сравнительно мало устойчив и легко разрушается при взаимодействии с кислотами. Как уже отмечалось, если на раствор аммиаката серебра, содержащего хлор-ионы, подействовать раствором азотной кислоты, то произойдет разрушение комплексного иона с выделением осадка AgCl ( см. стр. [16]
Комплексный ион [ Ag ( NH3) 4l сравнительно мало устойчив и легко разрушается при взаимодействии с кислотами. Как уже отмечалось, если на раствор аммиаката серебра, содержащего хлорид-ионы, подействовать раствором азотной кислоты, то произойдет разрушение комплексного иона с выделением осадка AgCl ( см. стр. [17]
Выпадает белый осадок хлорида серебра. Чем объясняется разрушение комплексного иона диаммин-серебра. [18]
Так, при действии аммиака на хлороплатинат калия происходит не просто присоединение аммиака к иону платины ( которого в растворе практически нет), а присоединение молекул аммиака к иону платины за счет оттеснения первоначально связанных с платиной ионов хлора. Естественно, что подобного рода процессы должны протекать с большим трудом, чем процессы присоединения компонента А к свободным ионам или к ионам, относительно непрочно связанным с водой. Кроме того, очевидно, что при процессах получения гексаминов, связанных с разрушением исходных комплексных ионов, существенную роль играет прочность связи этих последних. Понятно, что надо брать такие соединения, в которых содержатся наименее прочные исходные комплексы. [19]
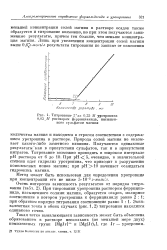 |
Титрование З мл 0 25 М уротропина. [20] |
Природа солей магния не оказывает какого-либо заметного влияния. Получаются одинаковые результаты как в присутствии сульфатов, так и в присутствии нитратов. При рН 5, очевидно, в значительной степени идет гидролиз уротропина, что приводит к разрушению комплексных ионов магния; при рН - 10 начинает осаждаться гидроокись магния. [21]
Если раствор имеет большую кислотность, то кислоту частично удаляют выпариванием, так как нейтрализация вводит ионы натрия или аммония, которые аналогичны ионам гидроксо-ния. Сорбцию многовалентных ионов облегчает разбавление раствора. В присутствии комплексообразователей, например цитратов, тартратов, добавление кислоты усиливает сорбцию катионов, так как уменьшение рН вызывает разрушение комплексных ионов. Добавление кислоты в случае карбоксильных катионитов может препятствовать сорбции противоионов, так как диссоциация карбоксильной группы подавляется. [22]
Отметим также возможное влияние соединений железа в процессах магнитогидродинамической активации щелочных вод. Как известно, при высоких рН ионы железа находятся не в свободной диссоциированной форме Fe 2 и Ре 3, а в составе комплексных ионов растворимых органических и неорганических соединений, вследствие чего ионы железа в щелочных водах не гидролизованы. Более того, при высоких рН возможно также нахождение в природных водах микрочастиц, содержащих окислы железа в ферромагнитной и парамагнитной форме. При дегидратации в магнитных полях ( возможный механизм которой рассмотрен в разделе 2.3), а также вследствие снижения рН можно ожидать разрушения комплексных ионов и образование нерастворимых гидроокисей железа. При коагуляции и осаждении в осадок СаСОз, Fe ( OH) 3 и других частиц органической и неорганической природы происходит адсорбция ионов из раствора, что фактически снижает минерализацию воды и способствует внесению в почву соединений кальция и железа. [23]
Страницы: 1 2