Электрохимическое разрушение - металл
Cтраница 1
Электрохимическое разрушение металла в процессе коррозии обусловливается наличием в нефти и нефтепродуктах соляной и серной кислот, солей этих кислот, сероводорода, кислорода, углекислоты и других газов. [1]
Особенно быстрое электрохимическое разрушение металлов наступает при их погружении в электролит или влажную среду. Из двух разных металлов, погруженных в электролит, один, менее благородный, будет переходить постепенно в раствор по законам электролиза, предохраняя тем самым другой, более благородный, от воздействия электролита. Таким образом, два разных металла в электролите образуют гальваническую пару. [2]
 |
Вытяжная камера для визуальной проверки распыления. [3] |
При электрохимическом разрушении металла определяются изменения величины электродного потенциала металла во времени. [4]
Другим важным случаем электрохимического разрушения металлов является их коррозия с кислородной деполяризацией. В связи с малой растворимостью кислорода в водных средах, а также в связи с тем, что его коэффициент диффузии значительно меньше коэффициента диффузии ионов водорода, скорость коррозии с кислородной деполяризацией обычно определяется диффузией. На рис. 99 в упрощенном виде представлена типичная поляризационная диаграмма процесса коррозии с кислородной деполяризацией. [5]
 |
Упрощенная поляризационная диаграмма коррозии с кислородной деполяризацией. [6] |
Другим важным случаем электрохимического разрушения металлов является их коррозия с кислородной деполяризацией. В связи с малой растворимостью кислорода в водных средах, а также в связи с тем, что его коэффициент диф фузии значительно меньше коэффициента диффузии ионов водорода, скорость коррозии с кислородной деполяризацией обычно лимитируется диффузией. На рис. 24.7 в упрощенном виде представлена типичная поляризационная диаграмма процесса коррозии с кислородной деполяризацией. [7]
 |
Схема процесса электрохимической коррозии. [8] |
Поскольку общий процесс электрохимического разрушения металла невозможен без катодного процесса, условия его осуществления во многом предопределяют стойкость материала. [9]
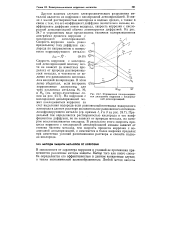 |
Упрощенная поляризационная диаграмма коррозии с кислородной деполяризацией. [10] |
Другим важным случаем электрохимического разрушения металлов является их коррозия с кислородной деполяризацией. В связи с малой растворимостью кислорода в водных средах, а также в связи с тем, что его коэффициент диффузии значительно меньше коэффициента диффузии ионов водорода, скорость коррозии с кислородной деполяризацией обычно лимитируется диффузией. На рис. 24.7 в упрощенном виде представлена типичная поляризационная диаграмма процесса коррозии с кислородной деполяризацией. [11]
Чтобы пояснить процесс электрохимического разрушения металлов, рассмотрим работу гальванического элемента, составленного из пластин ( электродов) цинка и меди. [12]
Способ основан на термическом и электрохимическом разрушении металла при прохождении электрического тока между двумя электродами ( заготовка - анод, инструмент - катод); разновидность электроэрозионной обработки. [13]
В таких местах происходит интенсивное электрохимическое разрушение металла трубы из-за выноса ионов металла с поверхности трубы в грунт. [14]
Коррозией называется процесс химического или электрохимического разрушения металлов и сплавов вследствие взаимодействия их с окружающей средой. Разрушающей средой при коррозии металлов и сплавов являются кислород воздуха, газы, водные растворы солей, кислот и щелочей. [15]
Страницы: 1 2 3 4