Разрыв - кратная связь
Cтраница 3
Реакция может служить для обнаружения непредельных углеводородов - бурая окраска брома быстро исчезает, Другой качественной реакцией на наличие кратных связей служит окисление перманганатом калия: непредельные соединения окисляются очень легко с разрывом кратных связей, а фиолетовая окраска КМпС4 при этом исчезает. [31]
Говоря об энергии связи, очень важно различать одинарные, двойные и тройные связи. Для разрыва кратных связей всегда требуется большая энергия, чем для разрыва одинарной связи между теми же атомами. [32]
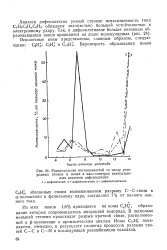 |
Распределение интенсивностей по числу углеродных атомов в ионах в масс-спектрах ненасыщенных аналогов дифенилэтана. 1 - дифенилэтан. 2 - дифенилэтилен. 3 - дифениладетилен. [33] |
Из этих ионов 1 6 % приходится на ионы С6Н6, образование которых сопровождалось миграцией водорода. В несколько меньшей степени происходит разрыв кратной связи, расположенной в р-положении к ароматическим циклам. Ионы CiaH появ ляются, очевидно, в результате сложных процессов разрыва связей С-С и С - Н и последующей рекомбинации осколков. [34]
Для реакции поликонденсации, так же как и для реакции полимеризации, необходимо, чтобы молекулы исходного вещества могли реагировать не менее чем с двумя другими молекулами. При поликонденсации это достигается не за счет разрыва кратных связей, а благодаря наличию в молекулах не менее двух реакшюнноспособных функциональных групп. [35]
Чрезвычайно важной для характеристики непредельных соединений является их способность к реакциям полимеризации, приводящим к получению высокомолекулярных соединений - полимеров. Процесс полимеризации заключается в соединении большого числа молекул исходного продукта между собой за счет разрыва кратных связей. [36]
При низких температурах в основном наблюдается физическая адсорбция, при которой молекулы веществ переходят из газовой фазы на поверхность твердого тела практически в неизменном виде и удерживаются на ней слабыми ван-дер-вааль-совыми силами. Такое взаимодействие может вызвать различного рода изменения в адсорбируемой молекуле: перераспределение зарядов между атомами в молекуле, разрыв кратных связей, деструкцию молекулы, образование кислородсодержащих адсорбированных соединений или углеводород-кислородных комплексов. [37]
Пик иона ( М - 85) ( т / е 67), как было показано [1], обусловлен фрагментом С5Н7, образовавшимся из кольца, не содержащего СО-группы. Это единственный интенсивный пик, происхождение которого не удается объяснить исходя из ранее установленных принципов фрагментации, и его образование должно включать разрыв кратных связей. Несмотря на то что набор из пяти дейтероаналогов гранс-декалона-1 позволяет охватить меткой все атомы углерода его молекулы, общая потеря дейтерия при образовании дегидратационного иона составляет всего около 80 % потери водорода, уходящего в виде воды, в случае немеченного соединения. Подобную разницу можно объяснить изотопным эффектом, величина которого близка к величине изотопного эффекта, наблюдавшегося при изучении характерного перегруппировочного процесса в случае метилового эфира масляной кислоты ( см. разд. [38]
Малые длины связей между кайносимметричными и немногослойными атомами С позволяют совершаться перекрыванию облаков л-электронов, а потому для химии углерода весьма характерны кратные связи в отличие от химии кремния. Эти связи настолько прочны ( этому способствует заметно и энергия корреляции) и вместе с тем в отсутствие катализаторов и высоких температур настолько мало реакцион-носпособны ( достаточно вспомнить необходимость платинового катализатора при гидрировании этиленовых производных), что органическая химия богата мономерами даже среди класса ненасыщенных соединений, молекулы которых могли бы полимеризоваться с разрывом кратных связей, если бы при помощи катализаторов была преодолена их инертность. Напомним, что и молекулы СО для своего сгорания в кислороде требуют катализаторов. Этилен полимеризуется при низких давлениях и температурах лишь в присутствии катализаторов, например, смеси триэтилалюминия и четы-реххлористого титана. [39]
Для образования макромолекулы одна из молекул ненасыщенного или циклического вещества должна быть переведена в состояние высокой активности. Такая молекула приобретает способность вступать в реакцию с неактивированными молекулами, последовательно присоединяя их. Реакционная способность растущей цепи при этом не утрачивается. Активация молекул ненасыщенного или циклического соединения связана с разрывом двойной связи или разрушением цикла. Если в результате разрыва связи молекула превращается в радикал, происходит радикальная полимеризация. Разрыв кратной связи молекулы может привести к образованию иона, в этом случае реакция протекает по законам ионной полимеризации. Если начальный ион приобретает положительный заряд, происходит катионная полимеризация, а в случае образования отрицательно заряженного иона-анионная полимеризация. [40]
Страницы: 1 2 3