Разрыв - простая связь
Cтраница 2
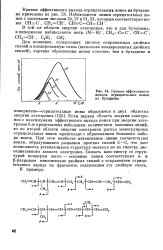 |
Кривые эффективного выхода отрицательных ионов из бутадиена. [16] |
Если первая область энергии электронов с максимумами эффективного выхода ионов при энергии электронов 6 эв представлена небольшим количеством массовых линий, то во второй области энергии электронов распад молекулярных отрицательных ионов происходит с образованием большого набора ионов. При этом наиболее интенсивные линии соответствуют ионам, образующимся разрывом простых связей С-С, что дает возможность устанавливать структуру молекул по их спектру диссоциативного захвата электронов. Связать масс-спектр со структурой молекулы легко - основные линии соответствуют а - и р-разрывам относительно двойных связей с сохранением отрицательного заряда на фрагменте, содержащем эту двойную связь. [17]
Это же можно сказать и об образовании ионов СН3, которые отсутствуют в спектрах последних трех соединений. Остальные ионы, как видно из схем распадов, образуются разрывом простых связей, что позволяет, как и в случае полиенов, провести простую и однозначную корреляцию между масс-спектром отрицательных ионов и структурой молекулы. Большая часть этих ионов имеет в своей структуре атом кремния, причем преобладает 3-разрыв со стороны гетероатома. [18]
Приведенные выше цифровые выражения энергии свявей не имеют абсолютного значения и указывают только на порядок соответственных вейичин, так как на разрыв связей С - С и С - Н в углеводородах различного строе4 ния нужны и несколько различные количества энергии. Кроме того для разрыва двойной связи требуется большее количество энергии, нежели для разрыва простой связи. Простая связь, граничащая с двойной связью, наоборот, как уже отмечалось выше, является более ослабленной ( см. гл. [19]
В определенной области рН HNO2 восстанавливается дальше. Таким образом, здесь, как и в случае нитрогруппы, на первом этапе происходит разрыв простой связи N-О, активированной другими атомами О. [20]
Все стадии, за исключением ( У) и ( о), экзотермические и, являясь реакциями переноса электронов или реакцией разрыва простой связи [ стадия ( 2) ], должны протекать исключительно быстро, как этого и требует данный кинетический механизм. Стадии ( i) и ( о) эндотермичны с тепловым эффектом соответственно 28 и 5 ккал, и эти величины находятся в согласии с энергиями активации указанных стадий, которые равны 28 zt 8 и 9 4 ккал. Эти термохимические данные, подобно кинетическим, косвенно подтверждают радикальный механизм. Такие термические данные требуют исключения некоторых стадий в тех случаях, когда эндотермический эффект становится столь большим, что реакция уже не может протекать с заметной скоростью. Этот вопрос будет далее рассмотрен подробнее. [21]
При радикальной цепной полимеризации активными частицами являются радикалы. Для их образования применяются инициаторы полимеризации; большинство из них является непрочными органическими и неорганическими перекисными соединениями. Молекула или ион инициатора легко распадается вследствие разрыва простой связи; при этом происходит разделение пары электронов, осуществляющих эту связь, и получается два радикала. Каждый из них имеет по одному неспаренному электрону ( R R - - 2R -) ( свободную валентность), за счет которого и происходит присоединение одной за другой молекул мономеров к радикалу; непрерывно растущий макрорадикал сохраняет неспаренный электрон до обрыва цепи. [22]
При радикальной цепной полимеризации активными частицами являются радикалы. Для их образования применяют инициаторы полимеризации; большинство из них являются непрочными органическими и неорганическими перекисными соединениями. Молекула или ион инициатора легко распадается вследствие разрыва простой связи; при этом происходит разделение пары электронов, осуществляющих эту связь и получаются два радикала. [23]
Структура, которую мы только что получили, не существует в действительности. А теперь мы просто можем получить исходные соединения а) путем разрыва простых связей, идущих после нарисованных нами двойных связей, и б) поместив двойную связь между двумя простыми связями. [24]
Биман [144] показал, что почти все процессы фрагментации, в результате которых наблюдаются интенсивные линии в масс-спектрах органических молекул, можно сгруппировать в ограниченное число типов реакций, которые он обозначил AI S, В и С. Была сделана попытка интерпретировать масс-спектры исходя из устойчивости продуктов в реакциях фрагментации. Формально предполагалось, что разрыв простой связи происходит без перегруппировки, так что в этом случае можно предсказать структуру иона, причем в первом приближении рассматривали только стабилизацию положительных осколочных ионов. Продукт разложения типа А4, как правило, не является бензильным производным ( разд. V, В), что, однако, не умаляет значения этих обобщений, хотя и показывает, что истинное положение вещей сложнее, чем схема. [25]
Другой причиной низкой дифференцирующей способности системы кодов Тайлхаймера является то обстоятельство, что в этих кодах не отражается кратность связей. По этой причине такие реакции, как приведенная выше реакция ( 34) и реакция № 665 ( 35), объединены под шифром СС § О, хотя это совершенно различные реакции. Происходит это потому, что разрывающаяся связь с кислородом не дифференцирована. В реакции ( 34) происходит разрыв двойной связи СО, а в ( 35) - разрыв простой связи СО. [26]
Избирательное каталитическое гидрирование особенно широко применяется для доказательства строения сераоргаттических соединений ряда бензтиофена и дибензтиофепа. В этих условиях удается практически полностью осуществить разрыв связен Г - S с последующим связыванием никелем серы, выделяющейся в виде сероводорода. В большей или меньшей степени идет при этом и насыщение водородом двойных связей в ароматических кольцах, по нот разрыва простых связей С - С. Установление строения полученных в этих условиях углеводородов является поэтому прямым ответом на вопрос о химической природе содержащихся в нефти сернистых соединений. Чем ниже температура гидрирования и продолжительность процесса, тем меньше задеваются двойные связи в бензольных кольцах. [27]
На основании большого экспериментального материала рядом авторов сформулирована гипотеза, по которой молекулы алкенов вступают в реакции, находясь в активированном бирадикальном состоянии. Радикал с двумя свободными валентностями получается из алкена путем разрыва связи С С с превращением двойной связи в одинарную. Эта гипотеза основана на том, что разрыв одной из двух связей требует меньшей затраты энергии, чем разрыв одинарной связи С - С. С другой стороны, полный разрыв молекулы по двойной связи в один акт невозможен, так как для такой реакции требуется значительно большая энергия, чем для разрыва простой связи. [28]
Важное значение энтропийных факторов в масс-спектрометрии, особенно для перегруппировок, было отмечено Филдом и Франклином [19], которые установили, что такие процессы могут идти с низкими энергиями активации. Поэтому перегруппировки должны преобладать в реакциях молекулярных ионов, образовавшихся при небольшом избытке внутренней энергии, поскольку такие ионы будут иметь сравнительно длительные времена жизни и могут успеть перегруппироваться до разложения. Количество избыточной внутренней энергии ионов может быть уменьшено, если эти ионы образуются при напряжении, едва превышающем потенциал появления. Если же при ионизации иону сообщается большой запас избыточной энергии, то разложение пойдет по путям, характеризующимся высокими факторами частоты и высокими энергиями активации, например путем разрыва простых связей. Таким образом, между разложением и перегруппировками имеется конкуренция, причем перегруппировки оказываются предпочтительнее при низкой энергии электронного пучка. [29]
Когда в образовании связи между двумя атомами участвуют лишь два электрона, то они образуют о ( сигма) - связь. Между атомами могут существовать кратные ( двойные и тройные) связи. Такие связи образованы двумя или тремя электронными парами. Кратные связи по прочности превышают простые, но необязательно в два или три раза. Так, энергия разрыва простой связи С-С в этане С2Н равна 85 ккал / моль, двойной С С в этилене СаН4 - 145 ккал / моль и тройной С С в ацетилену С2Н2 - 198 ккал / моль. Из этих данных можно сделать вывод о неравноценности различных видов в двойной и тройной связях. [30]
Страницы: 1 2