Разряд - ион - железо
Cтраница 2
Температура раствора хлоридов железа оказывает боль -; шое влияние на ДТЧ - С увеличением температуры умень -; шается адсорбционная способность железа, что повышает активацию поверхности катода. Подводимая энергия при, этом в большей степени расходуется на разряд ионов железа, чем при понижении температуры раствора хлоридов железа. [16]
D 1 а / дм2 и 25 С получается осадок металла, содержащий до 5 6 % Ni. В данном случае сказывается малая скорость разряда ионов никеля, подавляемая процессом разряда ионов железа ( см. гл. [17]
Однако большая склонность металлов группы железа к пассивированию не является основной причиной, обусловливающей их высокое металлическое перенапряжение, и не определяет расположения металлов по величине перенапряжения при их выделении из растворов простых солей. Даже после тщательной очистки электролитов от примесей и удаления из них-кислорода величина металлического перенапряжения разряда ионов железа остается большой. Свинец, который пассивируется значительно легче, чем железо, выделяется в то же время при более; низком перенапряжении. [18]
Собрав установку и подготовив электролит, приступают к опыту. Вначале компенсационным методом с каломельным электродом сравнения определяют зависимость iK - фк для суммарного процесса разряда ионов железа и водорода. Поляризационную кривую снимают в быстром темпе до достижения интенсивного выделения водорода и образования рыхлых катодных осадков. [19]
Однако уже сейчас можно предположить, что с увеличением плотности тока, с понижением температуры и кислотности электролита катодная поляризация растет, что приводит к получению более мелкозернистых и твердых покрытий. В этом случае катодный потенциал сдвигается в более отрицательную сторону, что приводит к сближению потенциалов разряда ионов железа и марганца, в результате чего создаются более благоприятные условия для их совместного осаждения. Поэтому с увеличением Дк и понижением температуры электролита содержание марганца в покрытиях увеличивается. Кроме того, образовавшиеся на поверхности катода адсорбционные пленки органических веществ при повышении катодного потенциала более интенсивно вовлекаются в растущий осадок и тем самым увеличивают в нем содержание углерода. В связи с этим повышение плотности тока, уменьшение температуры и кислотности электролита способствуют получению покрытий с повышенным содержанием углерода. [20]
Наличие его в, двойном слое снижает возможность прохождения через него ионов метал - ла, а следовательно, снижает и скорость основного процесса. Гейровского [ 69j о том, что причиной высокой поляризации железа может быть одновременное присоединение двух электронов при разряде ионов железа. Так как вероят - ность этого процесса мала, то его скорость является низкой; наличие катионного слоя вследствие того, что поверхность электрода при электрокристаллиэации оказывается заряженной отрицательно по отношению к раствору, создает дополнительный барьер, приводящий к высокому перенапряжение выделения железа на катоде. [21]
После включения тока на катоде происходят следующие явления: заряжение двойного слоя, выделение водорода, изменение состояния поверхности восстанавливаемой детали под влиянием Н2, повышение рН прикатодного слоя. Изменения качественного состояния поверхности и рН прикатодного слоя происходят в период времени ti, которое может через период т привести к постепенному созданию условий для разряда ионов железа. [22]
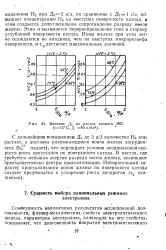 |
Влияние До на расход кислоты НС1 ( t75 С, Д 40 а / дм2... [23] |
OK падает), что порождает условия неодинаковой скорости роста кристаллов по поверхности катода. В местах, где требуется меньшая энергия разряда ионов железа, возникают преимущественно центры кристаллизации. [24]
Изучение процесса электроосаждения железа из водных растворов селей двухвалентного железа связано с выяснением причин высокой ка - тодной поляризации при разряде ионов металла. Показанный на рисунке код, ноляризационной ярнвой можно объяснить тем, что в начальный момент электролиза происходи преимущественный разряд ионов водорода. Перенапряжение ука-ванного процесса на железе достаточно велико и превышае1 перенапря-едше разряда ионов железа, благодаря чему становится возможным anei троосаждение железа. [25]
Катодная поляризация железного электрода в щелочных растворах по существу не отличается от поляризации других металлов, если не считать ранее отмеченной способности активированной поверхности железа окисляться даже при отрицательных потенциалах. В чистом растворе щелочи, не содержащем ионов железа, на железном катоде может протекать только один процесс - выделение водорода. Если в электролите содержатся ионы железа ( или другого металла с более положительным потенциалом осаждения, чем потенциал выделения водорода), то при катодной поляризации на электроде могут одновременно протекать два катодных процесса - выделение водорода и разряд ионов железа ( или другого металла) с осаждением его в виде металлической губки. Растворение катодно заряженных поверхностей железа в этих условиях происходить не должно. [26]
Страницы: 1 2