Разряд - ион - натрий
Cтраница 3
При изучении влияния силиката натрия на электролиз было отмечено, что после введения силиката натрия в рассол на поверхности катода образуется пленка кремневой кислоты, препятствующая разряду ионов натрия и приводящая к разряду ионов водорода. Если же рассол, содержащий силикат натрия, стоял до электролиза в течение нескольких часов, в процессе электролиза пленка не образовывалась и увеличение выделения водорода не наблюдалось. [31]
Данное обстоятельство совместно с очень большим перенапряжением водорода ( см.) на ртутном катоде, особенно при достаточно высоких плотностях тока, гарантирует, что преобладающей реакцией будет разряд ионов натрия. [32]
Таким образом, при наличии зерен галенита на жидком свинцовом катоде, благодаря их смачиванию жидким свинцом, электронной проводимости и возникающей деполяризации, восстановление на катоде происходит через разряд иона натрия. [33]
Создать столь высокое содержание ионов натрия в растворе NaCl явно невозможно; поэтому в реальных условиях нельзя ожидать первичного выделения натрия на твердом катоде. Разряд ионов натрия из раствора поваренной соли возможен только в том случае, если в качестве катода будет применена металлическая ртуть ( стр. [34]
Ртутный электрод обладает высоким перенапряжением водорода. Равновесный потенциал разряда ионов натрия на ртути значительно ниже нормального потенциала натрия из-за образования амальгамы. [35]
Концентрация исходного хлорида натрия в рассоле, поступающем на электролиз с ртутным катодом, не отличается от концентрации рассола, подаваемого в электролизер с твердым катодом и фильтрующей диафрагмой. Это обусловлено зависимостью потенциала разряда ионов натрия и хлора от их активности в растворе, а также растворимостью хлора, которая существенно зависит от концентрации исходной соли. Снижение концентрации хлорида сопровождается увеличением растворимости молекулярного хлора в рассоле и возрастанием скорости его восстановления на катоде. [36]
На ртутном катоде при электролизе раствора поваренной соли происходят разряд ионов Na и образование амальгамы натрия. На твердом катоде этот процесс разряда ионов натрия совсем не идет, так как потенциал выделения натрия в этом случае значительно более электроотрицателен, чем потенциал выделения водорода ( стр. [37]
Те же результаты получаются, если исходный электролит состоит из NaCI и КС1 с добавкой NaaSO... Стольнизкое напряжение разложения возможно только для разряда иона натрия на галените с деполяризацией за счет образования NaaS и для разряда ионов свинца. С учетом деполяризации при разряде иона натрия на галените напряжение разложения NaaS и PbS становятся одинаковыми. На аноде в обоих случаях выделяется сера, на катоде - свинец. [38]
Вследствие высокого перенапряжения выделения водорода на ртутном катоде происходит разряд ионов натрия, потенциал выделения которого ниже. Полученная при электролизе амальгама натрия затвердевает при относительно высокой температуре и утрачивает текучесть. При содержании 0 9 % натрия она затвердевает при 50 С. [39]
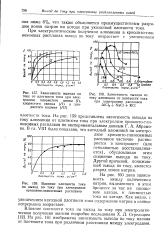 |
Зависимость выхода по току от плотности тока при электролизе хлористого цинка ( /, хлористого свинца ( / / и хлористого кадмия ( / / /.| Зависимость выхода по.| Влияние плотности тока. [40] |
VIII было показано, что катодный алюминий по электролизе криолито-глиноземных расплавов частично растворяется в электролите ( или неполностью восстанавливается), обусловливая этим снижение выхода по току. Другой причиной, понижающей выход по току, является разряд ионов натрия. [41]
В этих процессах стальное днище выполняет функции не катода, а механической основы и токопровода к жидкому металлическому катоду из ртути, расплавленного свинца или меди. Высокое перенапряжение выделения водорода на ртути и эффект деполяризации разряда ионов натрия при образовании амальгамы натрия позволяют осуществить с высоким выходом по току разряд ионов щелочного металла при электролизе водных растворов. При разложении амальгамы натрия водой в специальном разлагателе образуется щелочь и осуществляется регенерация чистой ртути. Особенности таких катодов подробнее будут рассмотрены в следующих главах. [42]
 |
Электролизер с ртутным катодом. [43] |
При электролизе с ртутным катодом каустическая сода получается более чистой с концентрацией 570 - 760 г / л NaOH. Главнейшим недостатком этого метода является повышенный расход-электрической энергии, обусловливаемой более высоким потенциалом разряда ионов натрия на ртутном катоде в сравнении с разрядом водорода на железном катоде. [44]
Каталитическое действие такого рода впервые было замечено в случае растворов, содержащих белковые вещества. Герлес и Ванчура [5] показали, что в растворе хлорида натрия после добавления к нему белка перед током разряда ионов натрия появляется особая волна, которую они назвали преднатриевой волной. Бабичка и Гейровский [6] нашли, что зависимость высоты этой волны в растворе хлористого аммония от концентрации белка стремится к пределу, а так как этот предел увеличивается при возрастании концентрации ионов аммония, то они [6] предположили, что в данном случае происходит снижение перенапряжения водорода, выделяющегося из иона аммония. При рН 12 волна исчезает, а при рН 7 ее невозможно отделить от волны выделения водорода из буфера. [45]
Страницы: 1 2 3 4