Разряд - катион
Cтраница 3
В стадии ( в) совмещены разряд катиона и взаимодействие полученного атома с уже имеющимся на электроде атомом, на холящимся в адсорбированном состоянии. По-видимому, процесс ( в) в отдельных случаях имеет существенное значение. [31]
При деполяризации катода может иметь место разряд катионов или образование анионов. [32]
В стадии ( в) совмещены разряд катиона и взаимодействие полученного атома с уже имеющимся на электроде атомом, находящимся в адсорбированном состоянии. По-видимому, процесс ( в) в отдельных случаях имеет существенное значение. [33]
Олово относится к числу металлов, разряд катионов которого на катоде протекает с высокой химической поляризацией при наличии в электролите небольших количеств поверхностно активных, веществ. Химическая поляризация возрастает еще больше, если в электролит наряду с поверхностно активными веществами вводится небольшое количество коллоида. [34]
При катодной поляризации на электроде происходит разряд катионов металла. Чтобы такая реакция протекала с конечной скоростью, необходим избыток электронов на поверхности сверх равновесного их количества. Поэтому потенциал электрода, нагруженного катодным током, будет сдвинут в отрицательном направлении. Если катодная реакция протекает без задержки, то катодная поляризация А. [35]
При электролизе такого раствора теоретически возможен разряд катионов Na и Н на катоде, анионов ОН и СГ на аноде. Какие из этих ионов и в какой последовательности будут в действительности разряжаться на электродах, зависит, в первую очередь, от величины и соотношения потенциалов разряда ионов в насыщенном нейтральном растворе NaCl. Поэтому из водных растворов, несмотря на низкую концентрацию в них водородных ионов, на твердом стальном катоде выделяется исключительно водород. [36]
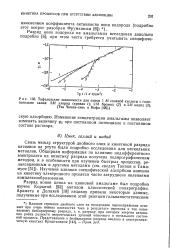 |
Тафелевские зависимости для смеси 1 М соляной кислоты с гало-генидами калия. 2М хлорид ( кривая /. 2М бромид ( 2 и 2М иодид ( 3. ( Тза Чюань-синь и Иофа. [37] |
Связь между структурой двойного слоя и кинетикой разряда катионов на ртути была подробно исследована для нескольких металлов. Изучение влияния специфической адсорбции анионов на кинетику электродного процесса часто затруднено явлениями комплексообразования. [38]
Так как повышение концентрации катионов уменьшает потенциал разряда катиона, то, естественно, из более концентрированных солей осаждение производится при меньшем потенциале, чем из более разбавленных растворов. Так, например, при электролизе 2 % - ного раствора AgNO3 в присутствии Cu ( NO3b медь, обладающая менее электроположительным потенциалом, на катоде не выделяется, если она содержится в небольшом количестве. Однако если концентрация меди достигнет 5 %, то начинается ее совместное выделение с серебром. [39]
На первой стадии восстановления ( а) происходят разряд катиона с потерей гидратной оболочки и адсорбция на поверхности электрода. Вторая стадия ( б) заключается в образовании молекул Н2 путем рекомбинации ионов Надс. [40]
Анионы галогенидов заметно ослабляют действие ПАВ и торможение разряда катионов металлов. При катодном выделении металлов из отрицательно заряженных комплексов введение галогенидов увеличивает ингибирующее действие органических катионов, например, при восстановлении SnF42 - в присутствии тетраалкиламмониевых солей. [41]
Анионы галогенидов заметно ослабляют действие ПАВ и торможение разряда катионов металлов. При катодном выделении металлов из отрицательно заряженных комплексов введение галогенидов увеличивает ингибирующее действие органических катионов, например, при восстановлении Snp42 - в присутствии тетраалкиламмониевых солей. [42]
 |
Зависимость перенапряжения водорода от плотности тока ( А / сма на ртутном электроде в подкисленных 1 н. [43] |
Рассмотрим теперь влияние специфически адсорбирующихся анионов на скорость реакции разряда катионов Н3О на ртутном электроде. При специфической адсорбции анионов потенциалы внутренней и внешней плоскостей Гельмгольца ( а следовательно, и г - потенциал) сдвигаются в отрицательную сторону, что согласно уравнению (50.3) должно уменьшать перенапряжение. На рис. 135 приведены кривые перенапряжения водорода на ртути в подкисленных растворах солей поверхностно-активных анионов при постоянной ионной силе раствора. [44]
Гейровский и другие использовали хронопотенцио-метрический метод при изучении процессов разряда катионов на ртутном электроде. Хронопотенциометрия представляет собой вариант метода кривых заряжания и заключается в быстрой ( порядка нескольких миллисекунд) осциллографической записи кривой зависимости потенциала от времени, которое в гальваностатическом режиме пропорционально количеству пропущенного электричества. [45]
Страницы: 1 2 3 4