Разряд - комплекс
Cтраница 1
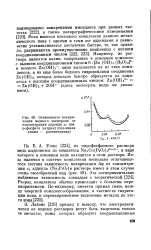 |
Зависимость поляризации медного электрода от концентрации адденда са ( пи-рофосфата натрия ( сплошная линия - рассчитанная. [1] |
Разряд комплексов обычно происходит с большим перенапряжением. [2]
Полученные ими выражения для разряда комплексов довольно сложны. Корыта [148] предложил более простой вывод уравнений, который приводится ниже. [3]
В комплексообразующих средах волны, относящиеся к разряду комплексов, не наблюдаются. [4]
В большинстве случаев химические реакции, предшествующие стадии разряда комплексов металлов, обратимы. [5]
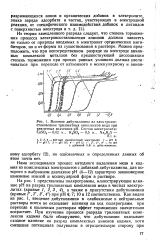 |
Влияние дибутиламина на электровосстановление трилонатных комплексов меди при различных значениях рН. Состав электролита. CuSO4 - 0 02 н., K2SO4 - 0 5 н., Na2H2Y. [6] |
На рис. 1 представлены полярограммы, иллюстрирующие влияние рН на разряд трилонатных комплексов меди в чистых электролитах, ( кривые 1, 2 3, 4), а также в присутствии дибутиламина ( кривые Г, 2, 3, 4) при рН 4; 7; 10 и 12 соответственно. Как видно из рис. 1, введение дибутиламина в слабокислые и нейтральные растворы почти не оказывает влияния на ход полярограмм, при переходе к щелочным растворам эффект торможения значительно возрастает. [7]
 |
Потенциалы восстановления свободных и координированных лигандов для некоторых комплексов молибдена ( III с пиридином, дипиридилом и фенантролином в ацето-нитриле. [8] |
По сравнению с ядром пиридина дипиридил или фенантролин обладают значительно большей способностью проявлять акцепторные свойства, чем и объясняется облегчение разряда комплекса на электроде при замещении пиридина на пиридил и фенантролин. [9]
При малых перенапряжениях разряжаются простые сольватированные ионы кадмия, возникающие в результате химической реакции диссоциации комплекса, при больших перенапряжениях скорость процесса определяется разрядом комплексов. [10]
Результаты определения состава преобладающих комплексов и комплексов, участвующих в электрохимической реакции, сопоставлены с литературными данными. В основном совпадение хорошее, что свидетельствует о перспективности осциллографической полярографии для изучения механизма разряда комплексов. [11]
Следует отметить, что индекс d здесь лишь условно характеризует диффузионную природу процесса, так как, хотя по высоте волна действительно диффузионная, однако процесс контролируется и последующей химической реакцией. Идея возможной дезактивации амальгамы была также использована Бернатом и Корытой [118] применительно к процессу разряда комплексов марганца. [12]
Для всех значений рН эта зависимость линейна. Значения коэффициентов b для второй волны изменяются в пределах 0 07 - 0 08 ( табл. 1), что соответствует случаю, когда торможение в основном носит активациониый характер. Предельный ток разряда комплексов кадмия с Н3Х, начиная с рН - 5, постепенно снижается. Так, при переходе от рН - 3 до рН - 12 величина / уменьшается примерно в 2 5 раза. Уменьшение / может быть связано с изменением состава комплекса, приводящим к резкому уменьшению подвижности разряжающихся ионов. Другой возможной причиной снижения предельного тока является частичное образование комплексов, не разряжающихся на электроде в исследуемом диапазоне потенциалов. [13]
Характерной особенностью многих электродных процессов, протекающих с участием комплексов металлов, является наличие химических реакций, предшествующих стадии разряда-ионизации. Эти реакции заключаются в отщеплении одного или нескольких лигандов от восстанавливающегося комплекса или их присоединении к окисляемому комплексу ( атому) металла. Высказывалось мнение [15], что в большинстве случаев химические реакции, предшествующие стадии разряда комплексов металлов, протекают в обратимых условиях. Механизм электродной реакции в подобных случаях может быть изучен путем исследования зависимости плотности тока обмена или скорости необратимо протекающего электродного процесса от концентрации комплексообразующих частиц, как это было рассмотрено выше. [14]
О восстанавливается, а вещества X и Y нет. Восстановление вещества О смещает равновесие ( 8) вправо, и общая скорость процесса определяется кинетикой переноса заряда, переноса вещества и химической реакцией. Эти процессы интенсивно изучены полярографическим и хронопотенциометри-ческим методами; с ними приходится сталкиваться в ряде случаев, например при разряде комплексов ионов металла ( разделы 3 и 4 гл. Основные идеи излагаются здесь на основе простых соображений [8 - 10], а подробности теории не рассматриваются. [15]
Страницы: 1 2