Разряд - электрод
Cтраница 2
Произведен ряд интересных экспериментов с электродами железо-никелевого аккумулятора, подвешенными на коромысле весов так, чтобы можно было измерять перемены - в весе, сопровождающие разряд электродов. При этом найдено, что как при заряде, так и при разряде происходят изменения в объеме активного материала. [16]
Кристаллические структуры р - МЮОН и Ni ( OH) 2 представляют собой гексагональные системы с близкими по значениям параметрами решетки ( а - 2 81 и 3 14 А, с - 4 84 и 4 60 А), что способствует образованию соединений переменного состава при разряде электрода. [17]
Какой из этих двух механизмов справедлив в данном случае оставалось неясным: с одной стороны, предположение о твердофазном превращении было трудно согласовать с экспериментально установленными фактами зависимости глубины окисления железа и кадмия от концентрации электролита и с возможностью полного восстановления гидроокисей, являющихся непроводниками; с другой стороны, имеющиеся в литературе данные о весьма низкой растворимости окислов этих металлов в щелочи, казалось, находились в противоречии с возможностью быстрого проведения заряда и разряда электродов, если предполагать, что реакция идет через раствор. [18]
Процессы на положительном электроде во многом аналогичны происходящим на окисно-никелевом электроде щелочных аккумуляторов. При разряде электрода, изготовленного из двуокиси марганца, так же как при разряде окисно-никелевого электрода не происходит строгого фазового перехода MnCte в МпООН, а содержание активного кислорода меняется непрерывно. Активность кислорода в МпО2 зависит от способа получения двуокиси марганца: электроды с искусственной двуокисью марганца обладают более высоким потенциалом, чем изготовленные из природной руды - пиролюзита. Повышается также емкость на единицу веса взятой двуокиси марганца. [19]
Процессы на положительном электроде во многом аналогичны происходящим на окисно-никелевом электроде щелочных аккумуляторов. При разряде электрода, изготовленного из двуокиси марганца, так же как при разряде окисно-никелевого электрода не происходит строгого фазового перехода MnCh в МпООН, а содержание активного кислорода меняется непрерывно. Активность кислорода в МпО2 зависит от способа получения двуокиси марганца: электроды с искусственной двуокисью марганца обладают более высоким потенциалом, чем изготовленные из природной руды - пиролюзита. Повышается также емкость на единицу веса взятой двуокиси марганца. [20]
В заряженном состоянии активные массы состоят из чистых металлов, а в разряженном состоянии - из гидроксидов этих металлов. Процессы заряда и разряда электродов протекают с участием железо - и кадмийсодержащих анионов, концентрация которых в концентрированных растворах щелочи достаточна для протекания этих электрохимических процессов со значительной скоростью. [21]
В процессе разряда количество металлического серебра в электроде непрерывно увеличивается с одновременным значительным ростом проводимости. Это облегчает конечную стадию разряда электрода, способствуя более полному использованию окиси серебра. [22]
Щербаковой было показано, что срок службы положительной активной массы существенно зависит от концентрации H2S04 в растворе. Было установлено, что если разряды электродов проводить в слабом, а заряды - в концентрированном растворе кислоты, то срок службы активной массы существенно увеличивается. Однако реально в эксплуатации таких концентрационных условий создать не представляется возможным. [23]
Соответственно увеличению поверхности снижается истинная плотность тока. Даже в случае заряда или разряда электрода большим общим током плотность тока, рассчитаганая да единицу истинной поверхности электрода, очень мала. Межэлектродный зазор может быть уменьшен до минимума. Практически в серебряно-цинковых аккумуляторах положительные и отрицательные электроды, разделенные пленочным сепаратором, вплотную прижаты друг к другу. Раствор электролита почти полностью находятся в порах отрицательных и положительных электродов, а также в набухшем сепараторе. Лишь по краям электродов находится небольшое ( около 10 % общего объема) количество свободного электролита. [24]
Однако слой Ag20 при этом не полностью пассивирует металл; практически полная пассивация металла происходит значительно позднее при более высоких потенциалах. Действительно, при дальнейшей поляризации в процессе разряда электрода на второй анодной ступени, когда происходит превращение обладающего большим сопротивлением Ag20 н проводящий окисел Ag202, металлическое серебро остается активным. [25]
Представляет интерес изучение влияния состава электролита на разрядные характеристики серных электродов, тем более, что в большинстве работ по источникам тока систематические исследования такого рода не проводились. В табл. 18 приведены значения выхода по току при разряде серного электрода током 1 25 ма / см2 в электролитах разного состава. Концентрация соли во всех случаях, кроме оговоренных специально, составляла 1 моль / л растворителя. [26]
Соответственно сдвигается и потенциал электрода. При полном превращении поверхностного слоя в Ni ( OH) 2 разряд электрода прекращается, так как концентрация носителей тока становится равной нулю. Внутренняя часть зерен гидрата остается при этом в значительной степени не восстановленной. [27]
 |
Распределение электродов. [28] |
На чувствительность фотоионизационного детектора существенное влияние оказывают геометрическая форма электродов, форма электрических полей детектора, режим его работы и форма газового разряда. Влияние формы распределения электрических полей и режимов работы рассмотрено в ряде статей Значительную роль играет форма коронного разряда и расположение относительно разряда поляризующих электродов. [29]
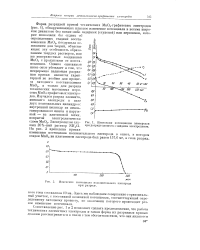 |
Изменения потенциалов электродов при разряде элемента с жидким электролитом.| Изменение потенциала положительного электрода при разряде. [30] |
Страницы: 1 2 3