Распад - активный комплекс
Cтраница 1
Распад активного комплекса можно считать колебанием лишь в пределе, когда частота этого колебания становится близкой к нулю. [1]
Для каталитической реакции необходимо, чтобы распад активного комплекса на мультиплете шел в направлении образования соединений, отличных от исходных, и чтобы молекулы этих соединений десорбировались с поверхности катализатора. Мультиплетная теория позволяет схематически представить механизм многих поверхностных реакций, а также объяснить процессы отравления и активации катализаторов, но она не рассматривает причины образования хемосорбционных связей между реагентами и катализаторами. Этот вопрос рассматривается в электронной теории катализа. [2]
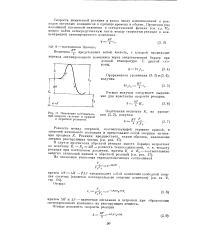 |
Изменение потенциаль - ния, получим. [3] |
Скорость химической реакции q равна числу возникновений и распадов активных комплексов в единице времени и объема. Применяя ряд положений квантовой механики и статистической физики ( см. гл. [4]
В окрестности состояния равновесия х - V2, и распад активных комплексов на продукты реакции может происходить очень быстро. В этих условиях кинетически лимитирующей стадией реакции (V.129) может стать реакция образования молекул активного комплекса. При этом константа скорости реакции k вдали от равновесия и вблизи от равновесия может меняться слабо или даже сохранять свою величину. Величина k определяется произведением двух зависящих от состава раствора сомножителей: х и е-до / г Изменение трансмиссионного коэффициента х может компенсироваться соответствующим изменением истинной стандартной свободной энтальпии активации AG, которая, как уже говорилось, может быть определена лишь, когда известен трансмиссионный коэффициент. В ходе реакции с изменением состава среды стандартное состояние изменяется. Причины таких влияний далеко не всегда изучены. В одних случаях это могут быть новые промежуточные комплексы, в других - перемена кинетически лимитирующей стадии реакции. [5]
Разработка теории абсолютных скоростей реакции показала, что скорость распада активного комплекса на продукты реакции равняется kT / h на моль, где k - постоянная Больц-мана, / г - постоянная Планка, а Т - абсолютная температура. [6]
В уравнении (V.5) трансмиссионный коэффициент хэ представляет собой вероятность распада активного комплекса А на продукты реакции. Отсюда часто да лается вывод, что сам комплекс недоступен экспериментальному исследованию. В теории РРКМ трансмиссионный коэффициент реакции непосредственно не рассматривается. Время жизни активного комплекса вполне определено, оно равно ( k &) 1 и может быть установлено экспериментально. Активный комплекс А доступен экспериментальному исследованию. [7]
За основу возьмем, что скорость реакции пропорциональна ( равна) скорости распада активного комплекса. Комплекс распадается по одной из связей, причем вероятность распада пропорциональна частоте колебаний по этой связи. Действительно, распад начинается в тот момент, когда колеблющиеся атомы находятся на максимальном расстоянии друг от друга. [8]
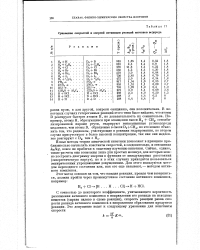 |
Сравнение скоростей в энергий активации реакций изотопов водорода. [9] |
С точностью до некоторого коэффициента, учитывающего вероятность разложения активного комплекса в направлении его распада на исходные вещества ( справа налево в схеме реакции), скорость реакции равна скорости распада активного комплекса в направлении образования продуктов реакции. [10]
Афанасьев указывает, что в уравнение Михаэлиса следует внести поправку, обусловленную тем, что комплекс ( FS) структурно отличается от неактивного адсорбционного промежуточного фермент-субстратного комплекса, и вводит новый коэффициент распада активного комплекса. [11]
Механизм гидрирования я-связи в присутствии этих катализаторов включает следующие стадии: 1) вследствие п - я - перехода образование квазиароматического цикла катализатор-олефин; 2) образование активного комплекса катализатор-олефин-водород ( при этом осуществляются а - я - или я - а - переходы); 3) распад активного комплекса с обратным переносом заряда от молекулярной системы к иону-катализатору. [12]
Механизм гидрирования я-связи в присутствии этих катализаторов включает следующие стадии: 1) вследствие п - л - перехода образование квазиароматического цикла катализатор - олефин; 2) образование активного комплекса катализатор - олефин - водород ( при этом осуществляются а - л - или л - а - переходы); 3) распад активного комплекса с обратным переносом заряда от молекулярной системы к иону-катализатору. [13]
Распределение активных центров иа поверхности катализатора обусловлено структурой его кристаллической решетки, причем максимальная каталитическая активность имеет место только на некоторых гранях кристаллов Молекула может быть адсорбирована под действием полей активных центров в том случае, если не менее двух центров расположено иа определенном расстоянии друг от друга и образует так называемый дуплет Во многих случаях для этой цели необходимо несколько активных центров, располо женных определенным образом, или мультиплет Для осуществления в системе каталитической реакции необходимо, чтобы распад активного комплекса иа муль-типлете шел в направлении образования соединении, отличных от исходных, и чтобы молекулы этих соединений десорбировались с поверхности катализатора Муль-типлетияя теория позволяет схематически представить механизм многих поверхностных реакций, а также объяснить процессы отравления и активации катализаторов Легкость образования активного комплекса зависит от геометрического соответствия системе активных центров и системы связей в молекуле реагирующего соединения. Это дает возможность объяснить избирательность действия катачизаторов. [14]
Первая стадия обеих реакций одинакова, но трансмиссионные коэффициенты хх и х2 различны. Распад активных комплексов протекает двумя параллельными, независимыми путями. [15]
Страницы: 1 2