Распад - кристалл
Cтраница 2
Обобщая эти явления, следует сказать, что процессы растворения суть процессы физико-химические; в одних случаях сильнее проявляется физическая сторона растворения ( распад кристаллов и диффузия), в других особенно ярко выражена химическая сторона-образование непрочных соединений растворителя с растворяемым веществом. Эта сторона процессов растворения была разработана Д. И. Менделеевым, автором химической теории растворов. Непрочные соединения растворяемого вещества с растворителем называются сольвата-м и, а в случае водных растворов - гидратами. [16]
Гуревич ( 53), в контакте с ртутью скорость процесса существенно возрастает, что авторы связывали с положительным сродством Ag и Hg, способствующим распаду кристалла. Это обусловлено следующими обстоятельствами. Примеси, с одной стороны, способствуют процессу диссоциации, деформируя решетку окиси, с другой стороны, они существенно влияют на электронные процессы. В простейшем случае ( наличие дефектов Френкеля) при диссоциации электроны от анионов О2 - переходят в полосу проводимости и улавливаются либо катионными центрами, либо анион-ыми вакансиями. При введении Cd2 число катионных вакансий растет, в результате чего понижается скорость их взаимодействия с электронами. [17]
Следует отметить, что в § 12.6 мы рассматривали реакцию C1F - - Cl F, энергия которой не может сравниваться непосредственно с энергией решетки, представляющей энергию распада кристалла на ионы. [18]
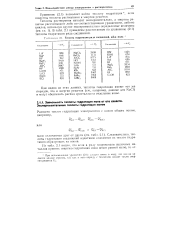 |
Теплота гидратации ряда соединений, кДж - моль. [19] |
Как видно из этих данных, теплоты гидратации имеют тот же порядок, что и энергии решеток ( см., например, данные для NaCl) и могут обеспечить распад кристалла на отдельные ионы. [20]
Другой случай, зависящий от деления кристаллического соединения на носитель структуры и на внедренные компоненты, представляют протекающие в значительном размере процессы замены одной структуры на другую ( деструкции) без распада кристалла. Однако такие процессы ( в этом случае большей частью полунепрерывные) встречаются и при других сложных кристаллических структурах, иллюстрируя, между прочим, насколько тесно могут быть связаны между собой структуры, по виду совершенно разнородные. [21]
Другой случай, зависящий от деления кристаллического соединения на носитель структуры и на внедренные компоненты, представляют протекающие в значительном размере процессы замены, одной структуры на другую ( деструкции) без распада кристалла. Однако такие процессы ( в этом случае большей частью полунепрерывные) встречаются и при других сложных кристаллических структурах, иллюстрируя, между прочим, насколько тесно могут быть связаны между собой структуры, по виду совершенно разнородные. [22]
Если кристалл хлористого натрия деформировать так, что расстояние между ионами достигнет одного ионного диаметра, то ионы хлора сблизятся с ионами хлора, а ионы натрия - с ионами натрия, и отталкивание ионов одноименного заряда вызовет распад кристалла. В металлах же все атомы одинаковы и любой из атомов может образовывать связи с любым другим атомом. Кроме того, валентные связи в кристалле металла, легко резонирующие из одного положения в другое, могут образовываться между соседними атомами даже в том случае, если кристалл подвергается деформации, и поэтому кристалл металла сохраняет свою прочность в процессе деформации. [23]
Если кристалл хлорида натрия деформировать так, что ионы сдвинутся относительно друг друга примерно на один ионный диаметр, то ионы хлора сблизятся с ионами хлора, а ионы натрия - с ионами натрия, и отталкивание ионов одноименного заряда вызовет распад кристалла. В металлах же все атомы одинаковы и любой из атомов может образовывать связи с любым другим атомом. Кроме того, валентные связи в кристалле металла, легко резонирующие из одного положения в другое, могут образовываться между соседними атомами даже в том случае, если кристалл подвергается деформации, и поэтому кристалл металла сохраняет свою прочность в процессе деформации. [24]
Мусковит и биотит при нагревании до 1073 К постепенно и медленно теряют воду. Распад кристаллов слюд наблюдается в интервале температур от 1 - 173 до 1373 К. [25]
 |
Микрофотографии исходного ( а и дегидратированного ( б байерита. [26] |
По мнению Де Бура [33], слои связаны друг с другом остатками незакристаллизовавшегося в новую фазу аморфного вещества. Предотвращать распад кристалла по щелям может также наличие обменных катионов, примесей или дефектность кристаллической решетки, приводящая к частичной накладке в отдельных местах смежных слоев. [27]
 |
Схема процесса распада кристалла NaCl на ионы. [28] |
Диссоциация электролита на ионы протекает при участии полярных молекул растворителя. На рис. 39 изображен процесс распада кристалла хлористого натрия на ионы. Полярные молекулы воды притягиваются своими отрицательными полюсами к ионам натрия, а положительными полюсами - к ионам хлора. Непрерывное движение молекул воды приводит к отрыву ионов натрия и хлора от поверхности кристалла. [29]
 |
Схема растворения хлорида натрия в воде. [30] |
Страницы: 1 2 3