Медленный распад
Cтраница 4
Именно таким образом по периоду полураспада радия был определен период полураспада урана, который невозможно измерить непосредственно из-за слишком медленного распада. [46]
Таким образом, и в этом применении выражение для ведущей реакции в конденсированной фазе дает результаты, еще более близкие к экспериментальным, чем формула газофазовой реакции, особенно при использовании для расчета в последнем случае константы скорости термического распада. Следует добавить, что расчет для конденсированной фазы ближе к экспериментальным данным, так как, во-первых, протекание реакции в жидкости больше соответствует условиям медленного распада и, во-вторых, различие в температурах гораздо меньше, чем если данные медленного распада экстраполировать на максимальную температуру горения. Поэтому в целом теория ведущей реакции в конденсированной фазе не хуже, а скорее даже лучше описывает экспериментальные данные, полученные для плавящихся вторичных ВВ, в отношении абсолютной велжчи-ны скорости, ее зависимости от начальной температуры, а также от давления. [47]
В реках процесс распада и окисления идет несколько быстрее. Взвешенные вещества, следовательно, медленнее подвергаются распаду и окислению; в силу этого нежелательно загружать водоем взвешенными веществами, которые оседают на дно реки и там подвергаются весьма медленному распаду. [48]
В дальнейшем попытки расчета абсолютного значения скорости горения были произведены применительно к другим ВВ. Так, Арден и ГГаулинг [139] рассчитали скорость горения паров метилнитрита, приняв температуру горения, соответствующую экспериментально определенному составу сто продуктов, и кинетические константы, установленные для медленного распада, дающего, правда, иные конечные продукты. Этот расчет дал и 120 см / сек вместо 3 2 см / сек, определенных экспериментально. [49]
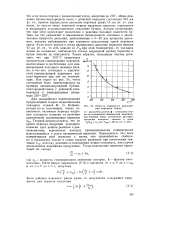 |
Область взрывного разложения перекиси этила. [50] |
Авторы утверждают, что при этом происходит вовлечение в реакцию больших количеств бутана, на что указывают и повышенная интенсивность свечения и значительные приросты давления, превышающие в 5 - 10 раз приросты давления, которые наблюдаются при взрывном разложении одной перекиси этила. Если после впуска в сосуд парциальное давление перекиси меньше 13 мм рт. ст., то есть меньше ее Pup при этой температуре, то холодное пламя не возникает, наблюдается только медленный распад перекиси и бутан заметно не окисляется. Таким образом, описанным опытом доказано, что при 210 С существует критическая концентрация перекиси, необходимая и достаточная для инициирования холодного пламени бутана, и что она совпадает с критической концентрацией взрывного распада перекиси при той же температуре. [51]
Как видно, в конкуренции с простыми телами OF2 всегда оказывается в невыгодном положении. Только довольно значительная энергия активации ( около 41 ккал) распада OF2 позволяет этому веществу вплоть до 150 и даже до 250 С существовать в химически замороженном состоянии или в состоянии медленного распада. [52]
Страницы: 1 2 3 4