Простой распад
Cтраница 1
Простой распад сводится к единственному элементарному акту разрыва связи. [1]
 |
Зависимость скорости разветвления цепей в реакции окисления ме-тилэтилкетона от суммарной концентрации диацетила и кетогидроперекиси. [2] |
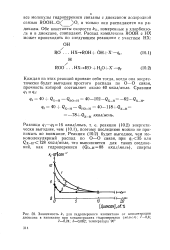
Простой распад гидроперекиси по связи О - О протекает сравнительно медленно, и образование радикалов в условиях окисления происходит при взаимодействии гидроперекисей с продуктами окисления. В этих реакциях могут принимать участие спирты, кетоны, кислоты. [3]
Механизм простого распада [ уравнение ( 3) ] в газовой фазе в общем случае маловероятен. Br) - 280, D ( CH2 СНСН2Вг) 190, D ( PhCH2 - Br) 211 кДж - моль-1) и потому предпочтительно протекает гемолитический разрыв связи. Следует, однако, иметь в виду, что такое превращение будет сопровождаться конкурирующими и последо-вательными процессами распада. [4]
Таким образом, если простой распад отвечает большей энергии активации Е0 ( потенциал появления в первом приближении) по сравнению с конкурирующей перегруппировкой, то его вероятность монотонно уменьшается по сравнению с перегруппировкой с уменьшением энергии ионизирующих электронов или, иначе говоря, с приближением к энергии активации. [5]
Таким образом, процесс простого распада углеводородов на более мелкие молекулы при температурах от 50 С и выше и относительно малом времени контакта над активным алюмосиликатом, например флоридином, может не сопровождаться термическими реакциями глубокого разрушения. [6]
Преобладающей реакцией в разложении ацетальдегида является простой распад на метан и окись углерода. [7]
Скелетные перегруппировки наблюдаются в масс-спектрах имидов лишь тогда, когда простой распад неблагоприятен. [8]
Распад ацетилена сопровождается выделением энергии именно потому что в действительности происходит не простой распад на составные части, а перегруппировка. Так, образующиеся в последней реакции молекулы С2, находящиеся в газовой фазе, могут конденсироваться в твердый углерод ( графит), выделяя 198 ккал / моль. [9]
Продукты фоторазложения солей диазония в водных растворах, по-видимому, хорошо объясняются простым распадом в первичном процессе ( XLI) на молекулярный азот и карбониевый ион. [10]
 |
Зависимость & для гидроперекиси изопентана от концентрации. [11] |
Каждая из этих реакций проявит себя тогда, когда она энергетически будет выгоднее простого распада по О - О связи, прочность которой составляет около 40 ккал / моль. [12]
При растворении пятиокиси азота в азотной кислоте не наблюдается изменения ковалентности, но происходит такой же простой распад на ионы, как и при растворении хлористого натрия в воде. Однако, как и хлористый натрий, пятиокись азота испаряется с сохранением ковалентной структуры. [13]
Если наблюдаются отклонения от соотношения для h0 и они не связаны непосредственно с предположением о коэффициентах активности, то такие отклонения можно считать указанием на то, что простой распад сопряженной кислоты субстрата не отражает истинного механизма реакции. [14]
Если наблюдаются отклонения от соотношения для / г0 и они не связаны непосредственно с предположением о коэффициентах активности, то такие отклонения можно считать указанием на то, что простой распад сопряженной кислоты субстрата не отражает истинного механизма реакции. [15]
Страницы: 1 2