Расплав - хлорид - щелочной металл
Cтраница 1
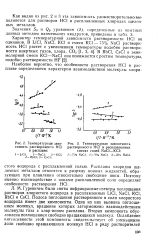 |
Температурная зави - [ IMAGE ] Температурная зависимость симость растворимости НС1 растворимости НС1 в расплавленных в расплаве. смесях солей NaCl-KCI. [1] |
Расплавы хлоридов щелочных металлов относятся к разряду ионных жидкостей, образующих при плавлении относительно свободные ионы. [2]
 |
Коррозия титана в расплавах солей КС1, LiCl и смеси КС1 - т LiCl. [3] |
При коррозии титана в расплавах хлоридов щелочных металлов на его поверхности образуется темный порошкообразный налет. Рентгеновским анализом установлено, что налет имеет гексагональную решетку, присущую также и титану, но с несколько большими параметрами, чем у решетки чистого титана. [4]
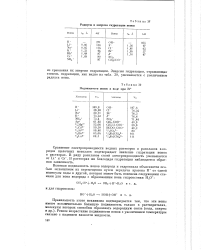 |
Радиусы и энергия гидратации ионов.| Подвижности ионов в воде при 25. [5] |
Сравнение электропроводности водных растворов и расплавов хлоридов щелочных металлов подтверждает значение гидратации ионов в растворах. В растворах же благодаря гидратации наблюдается обратная зависимость. [6]
Интенсивнее идет хлорирование пентаоксида ванадия в расплаве хлоридов щелочных металлов в присутствии восстановителя. Промежуточные продукты хлорирования ( VO2C1, VOC12, VOC1, VCls) образуют с хлоридами щелочных металлов комплексные соединения, которые являются хорошими переносчиками хлора и кислорода, тем самым способствуя ускорению процесса хлорирования. Предложено [38] пентаоксид ванадия хлорировать в эквимольной смеси КС1 - NaCl при 700 - 800 С, содержании 10 - 30 % V2O5, 3 - 7 % углерода. Достигнутый при этом выход VOCls составил 1 35 кг / ч на 1 кг расплава. [7]
 |
Зависимость краевого угла при смачивании никеля расплавов NaCl - КС1 от содержания NaCl при различных температурах. [8] |
Помимо расплава щелочных металлов практический интерес представляет смачивание различных поверхностей расплавами хлоридов щелочных металлов. [9]
Для увеличения интенсивности процесса предлагалось хлорировать в расплаве солей, в частности в расплаве хлоридов щелочных металлов [30], аналогично методу, применяемому к магниевому и титановому сырью. Наряду с физическими преимуществами проведения процесса в жидкой среде при хлорировании в расплаве могут быть созданы особо благоприятные физико-химические условия, так как расплав хлоридов не является химически индифферентной средой в отношении хлорируемого материала. [10]
Для увеличения интенсивности процесса предлагалось хлорировать берилл в расплаве солей, в частности в расплаве хлоридов щелочных металлов [74], аналогично методу, применяемому к магниевому и титановому сырью. Наряду с физическими преимуществами проведения процесса в жидкой среде при хлорировании в расплаве могут быть созданы особо благоприятные физико-химические условия, так как расплав хлоридов не является химически индифферентной средой в отношении хлорируемого материала. При 950 наблюдается практически полное разложение берилла. [11]
В последние годы в промышленной практике преимущественно применяют электролиз фторида тория ( или комплексного фторида KThFs) в расплаве хлоридов щелочных металлов. [12]
Переработка торийсодержащих руд сводится к выделению ТпО2 с последующим кальцийтермическим восстановлением или к электролизу растворов ThF4 или ThCl4 в расплавах хлоридов щелочных металлов. Для получения тория высокой чистоты термически разлагают ТЫ4 на раскаленной нити. [13]
Переработка торийсодержащих руд сводится к выделению ThO2 с последующим кальцийтермическим восстановлением или к электролизу растворов ThF4 или ТЬС14 в расплавах хлоридов щелочных металлов. Торий выделяется на катоде в виде порошка. Компактный металл получают переплавкой в вакууме или в инертной атмосфере. Для получения тория высокой чистоты используют термическое разложение ThI4 на раскаленной нити. [14]
Переработка торийсодержащих руд сводится к выделению ThO2 с последующим кальцийтермическим восстановлением или к электролизу растворов ThF4 или ThCl / j в расплавах хлоридов щелочных металлов. Для получения тория высокой чистоты термически разлагают ТЫ4 на раскаленной нити. [15]
Страницы: 1 2