Расплав - хлорид - щелочной металл
Cтраница 2
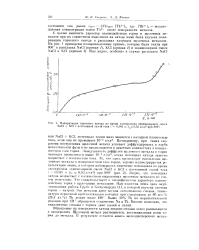 |
Поляризация ториевого катода во время электролиза эквимолярнои смеси NaCl KC1 с постоянной сплои тока i 0 041 я, г кгО 02 а / см2 при 806. [16] |
С целью выяснить характер взаимодействия тория и щелочных металлов при их совместном выделении на катоде нами была изучена поляризация ториевого катода в расплавах хлоридов щелочных металлов. [17]
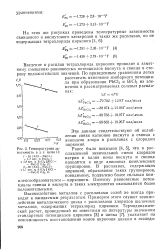 |
Температурная зависимость э. д. с. цепи II. [18] |
Взаимодействие металлов с расплавами солей не всегда приводит к ожидаемым результатам. Примером этого служит взаимодействие металлического цинка с расплавами хлоридов щелочных металлов, содержащих тетрахлорид циркония. [19]
Были поставлены опыты по изучению катодной поляризации в расплавах хлоридов щелочных металлов, содержащих цирконий и уран. [20]
 |
Хлорирование различных модификаций кремнезема. [21] |
Значительно снизить температуру реакции удалось при хлорировании диатомита в среде расплавленных солей [ 55, 56, с. Изучено влияние различных факторов на степень хлорирования диатомита в расплаве хлоридов щелочных металлов. На хлорируемость диатомита заметно влияет степень размола восстановителя. [22]
С образующийся трихлорид железа восстанавливается до малолетучего дихлорида, который препятствует свободному доступу хлора к поверхности ферровольфрама. Как и в случае ферромолибдена, предпочтительно вести процесс хлорирования в расплаве хлоридов щелочных металлов. С помощью солевой очистки удается снизить содержание железа и алюминия до 0 003 и 0 001 % соответственно. [23]
 |
Количественное соотношение анодного и катодного процессов. [24] |
Следовательно, при низких анодных плотностях тока основная доля растворившегося металла сосредотачивается в электролите в виде находящейся в динамическом равновесии смеси мелкодисперсного металла ди - и тетрахлорида циркония. Такое распределение продуктов анодного растворения циркония еще раз говорит о том, что дихлорид циркония практически нерастворим в расплавах хлоридов щелочных металлов и существует в них лишь в контакте с металлом. Нарушение равновесия между анодным и катодным процессами, увеличивающееся с уменьшением анодной плотности тока, свидетельствует о том, что образующийся на аноде двухвалентный цирконий непосредственно не участвует в катодном процессе. Следовательно, анодная плотность тока в случае-циркония, дихлорид которого практически нерастворим в изучаемых расплавах, не может влиять на процесс электрорафинирования так, как это имеет место в случае титана, низшие хлориды которого растворимы в хлоридных расплавах. [25]
Хлорирование ванадийсодержащих руд, шпинелей, шлаков. Хлорирование руд или других ванадийсодержащих концентратов используется преимущественно как один из способов извлечения ванадия. Так, показана [43, 44] возможность практически полного извлечения ванадия из конверторного шлака хлорированием в среде расплава хлоридов щелочных металлов. Железованадиевые шпинели состава FeO - V2Os хлорируют при 160 - 220 С с образованием оксихлорида ванадия. [26]
Величины удельной электропроводности расплавов труднее сравнивать между собой, чем величины удельных элек-тропроводностей, полученные для водных растворов, ввиду того что температура и вязкость расплавов изменяются в широких пределах. Величины удельной электропроводности в расплавах типичных солей, таких, как хлориды щелочных металлов, при температуре плавления имеют тот же порядок, что и в водных растворах. Поэтому нет сомнения, что в расплавах они существуют главным образом в виде свободных ионов и являются своего рода новым типом растворителя, в котором силы межионного взаимодействия достаточно велики. Однако данные для расплавов хлоридов щелочных металлов отличаются отданных, полученных для их водных растворов; в расплавах электропроводность наиболее высока для солей лития и уменьшается с увеличением кристаллографического радиуса катиона. Это соответствует предположению о том, что в отсутствие растворителя ион, лишенный оболочки, двигается в соответствующем направлении при наложении электрического поля. Расплавы хлоридов щелочноземельных металлов также имеют высокую удельную электропроводность, но здесь порядок их расположения обратный: удельная электропроводность MgCl2 вдвое меньше, чем BaCl 2, a BeCl 2 - очень слабый электролит. Этот эффект можно объяснить образованием ионных пар; если двигаться вправо по периодической таблице, то влияние увеличения валентности усиливается, так как усиливается тенденция к образованию ковалентных связей. [27]
Страницы: 1 2