Расположение - металл
Cтраница 1
Расположение металлов в ряду напряжений играет роль не только при нанесении покрытий, но и при конструировании деталей из различных металлов. Здесь также необходимо исключить образование гальванических элементов. В первую очередь это относится к металлам, находящимся в электрическом контакте; неблагородный металл при этом растворяется. Для того чтобы покрытия удовлетворяли указанным требованиям, разработаны соответствующие нормы, которые, ввиду их важности, рассматриваются отдельно ( стр. Нормирована также и минимальная толщина покрытий, гарантирующая в определенных условиях удо влетворительный срок службы покрытия. [1]
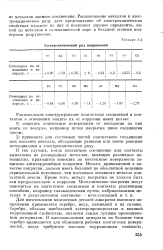
Расположение металлов в ряд по величине внутренних напряжений, возникающих при нанесении электролитического покрытия, является очень сложной задачей, так как величина внутренних напряжений резко зависит от ряда факторов. Для такого сопоставления необходимо подобрать совершенно одинаковые условия электролитического выделения металла, что для большинства металлов практически невозможно осуществить. Поскольку величина внутренних напряжений в сильной степени зависит от природы применяемой соли, то для сравнения величин внутренних напряжений различных металлов, естественно, необходимо применять соли одних и тех же кислот. К сожалению, это не учитывается многими исследователями. Кроме анионов, и другие условия осаждения ( остальные компоненты раствора, условия электролиза) оказывают сильное влияние на внутренние напряжения. Поэтому на основании литературных данных очень трудно точно расположить в ряд металлы по величине их внутренних напряжений. В табл. 15 приведены данные для ряда металлов, полученные различными авторами. [2]
Расположение металлов в ряд по величине внутренних напряжений является очень сложной задачей, так как величина внутренних напряжений резко изменяется в зависимости от многих факторов. Для такого сопоставления необходимо подобрать совершенно одинаковые условия электролитического выделения металла, что практически для большинства металлов невозможно. Поскольку величина внутренних напряжений в сильной степени зависит от природы применяемой соли и условий электролиза, то данные о внутренних напряжениях для одних и тех же металлов, полученные разными исследователями, часто значительно расходятся. В табл. 36 приведены данные различных авторов для ряда металлов. Как видно, данные для одного и того же металла отличаются в некоторых случаях в два с лишним раза. Так, например, для меди, по данным В. С. Иоффе, внутренние напряжения составляют 500 кГ / см2, а по данным Н. П. Федотьева и А. Аналогичные расхождения имеют место при осаждении других металлов. [3]
 |
Электрохимический ряд напряжений. [4] |
Расположение металлов в электрохимическом ряду дает представление об электрохимических свойствах каждого из них и позволяет заранее определить, какой из металлов в гальванической паре в большей степени подвержен разрушению. [5]
Расположение металлов по их активности оказывается приблизительно таким же, как и для реакции между Н2 и D2, хотя различия несколько меньше. Это может быть следствием высоких температур, при которых изучалась гидрогенизация бензола. [6]
Расположение металлов в электрохимическом ряду дает представление об электрохимических свойствах каждого из них и позволяет заранее определить, какой металл в гальванической паре будет больше подвержен разрушению. Например, нельзя допускать непосредственного соединения меди и алюминия, так как разность потенциалов между ними составляет 1 685 в. [7]
 |
Схема строения кристаллов металлов. [8] |
Расположение металлов в различных местах периодической системы химических элементов показывает, что многие свойства у них должны сильно различаться. Наряду с этим имеются, однако, некоторые свойства, которые присущи всем металлам. Металлы, за исключением ртути - вещества твердые. Все металлы обладают характерным металлическим блеском, который обусловливается способностью их сильно отражать лучи света. Большинство из-них сохраняет блеск только тогда, когда они находятся в сплошной массе. В мелкораздробленном виде-болыпинство металлов имеет черный или серый цвет. Металлы хорошо проводят тепло и электричество, причем лучшие проводники тепла являются и лучшими проводниками электрического тока. Наиболее хорошо проводят тепло и электричество серебро и медь, наименее - свинец и ртуть. [9]
 |
Стандартные электродные потенциалы в растворах и расплавах хлоридов. [10] |
Расположение металлов в ряду напряжений совпадает с рядом металлов, который получил еще Н. Н. Бекетов ( 1865) на основании опытов по взаимному вытеснению металлов. [11]
Расположение металлов в ряду напряжений соответствует их расположению в ряду, предложенном Н. Н. Бекетовым ( с. Стандартный потенциал растворения является объективной мерой химической активности данного металла. [12]
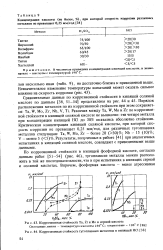 |
Коррозионная стойкость тугоплавких металлов в кипящей НС1. [13] |
Порядок расположения металлов по их коррозионной стойкости при этом сохраняется: Та, W, Mo, Zr, Mb, V, Ti. Различия между Та, W, Мо и Zr по коррозионной стойкости в кипящей соляной кислоте не выявлено: эти четыре металла при концентрации кипящей НС1 до 30 % оказались абсолютно стойкими. Результаты, полученные в работе [41] при аналогичных испытаниях в кипящей соляной кислоте, совпадают с приведенными выше данными. [14]
Порядок расположения металлов по степени их необратимости, а следовательно, и по величине металлического перенапряжения практически не зависит от того, осаждается ли металл на твердом одноименном катоде или на разбавленной амальгаме соответствующего металла. Оно протекает здесь еще менее обратимо, чем на твердых катодах. Однако эти металлы почти не способны образовывать амальгамы, и их осаждение в случае применения ртутных катодов совершается на плохо связанных между собой мелких кристаллических островках. [15]
Страницы: 1 2 3 4 5