Расположение - метильная группа
Cтраница 2
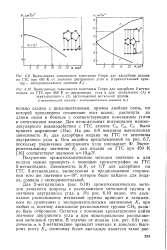
Все экспериментальные данные говорят о том, что в процессе биосинтеза болдина ( 166) в Litsea glutinosa меняется исходное положение 0-метильных групп. Истинному направлению процесса соответствует такое расположение метильных групп, которое имеется в изоболдине ( 165); выводы о механизме циклизации, сделанные на основании расположения метильных групп в болдине, некорректны. [16]
Аналогичная картива наблюдается в случае конденсации р-метилнафталина и метанола. Однако реакционная способность исследованных углеводородов неодинакова и зависит от расположения метильной группы. Как видно из таблицы ( см. с. [17]
Все данные, однако, находятся в согласии с малой величиной барьера, не превышающей 1 ккал / молъ. В связи с этим вполне допустимо предположить, что незаслоненное расположение метильной группы в кетоне по отношению к карбонильной группе на 0 1 ккал / молъ выгоднее заслоненного расположения. [18]
По структуре представляет собой триметил-бензол, отличающийся от мезитилена расположением метильных групп при кольце. [19]
Согласно расчетным данным, предпочтительнее ф3 - конформер с трансоидным расположением метильной группы и свободной электронной пары у атома азота ( обозначение этой конформации дано по уникальному заместителю у азота - электронной паре. Для 2-дейтероизопропиламина также возможны два конформера - ( 87) и ( 88); более устойчив конформер ( 87) со скошенным расположением обеих метильных групп относительно свободной электронной пары атома азота. [20]
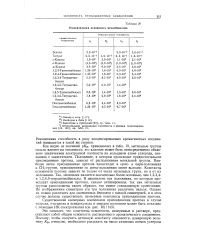 |
Относительная основность метилбензолов. [21] |
Как видно из значений р / Св, приведенных в табл. 19, метальные группы сильно влияют на основность; это влияние может быть непосредственно объяснено увеличением электронной плотности на кольцевом атоме углерода, связанном с заместителем. Положение, в котором происходит предпочтительное присоединение протона, зависит от расположения метильной группы. Наиболее легко присоединение протона происходит в орто - и пара-положения к СН3 - группе, присоединение по мета-положению менее выгодно. [22]
Все экспериментальные данные говорят о том, что в процессе биосинтеза болдина ( 166) в Litsea glutinosa меняется исходное положение 0-метильных групп. Истинному направлению процесса соответствует такое расположение метильных групп, которое имеется в изоболдине ( 165); выводы о механизме циклизации, сделанные на основании расположения метильных групп в болдине, некорректны. [23]
Напомним еще раз, что заслоненные конформации энергетически невыгодны и в конформационном равновесии практически не участвуют. Поэтому рассматривать мы будем как правило, три заторможенные конформации, а из заслоненных - только конформацию ф ( 37), которую будем называть цисоидной, поскольку сближенное расположение метильных групп напоминает таковое в цис-форме л-диастереомеров. [24]
В триарома-тических стеранах 620 и С21 заместитель при С-17 соответственно этильный и изопропильный. Фрагментный ион с т / е 259 характерен для ароматических стеранов, образовавшихся из 4-метил-стеранов. Расположение метильных групп в триароматических стеранах С27 - С29 не установлено. [25]
Для 2-метилиндана ( рис. 6.10) хроматоскопическим методом решаются вопросы о расположении метильной группы и значении двугранного угла а. Из рис. 6.10 видно, что аксиальное расположение метильной группы приводит к заниженным по сравнению с экспериментальными значениями Ki при любых а, поэтому аксиальное расположение группы СН3 должно быть отброшено. Остается с помощью хроматоскопии найти значение двугранного угла а при экваториальном расположении метильной группы. [27]
Эта реакция синтеза дигидропиридина ( 6) дает своеобразный пример нуклеофильного присоединения карб-аниона по стерически наиболее труднодоступному из двух имеющихся а-положений пиридиниевого кольца. На следующей стадии осуществляют восстановление енамина ( 6) в тетрагидро-пиридин ( 7), который затем подвергают внутримолекулярной реакции электрофильного замещения в ароматическом кольце ( конц. При кислотно-катализируемом ал-килировании бензольного ядра возможно образование двух кар-бокатионов с аксиальным ( 7а) или экваториальным ( 76) расположением метильной группы при С-3 гетероцикла. [28]
Оказалось, что присутствие СН3 - групп затрудняет гидрогенолиз связи, прилежащей к заместителю, подобно тому, как - это наблюдалось в случае циклопентанов и циклогептанов. Преимущественное направление трансаннулярнои дегидроциклизации в ряду алкилциклоалканов со средним размером кольца связано, по-видимому, с конформационными особенностями циклоалканов. Так, дегидроциклизация метилциклооктана приводит главным образом к 2-метилбицикло - [3.3.0] октану, в то время как из метилциклононана преимущественно образуется бициклический углеводород с ангулярным расположением метильной группы за счет отщепления интрааннулярного атома водорода при углероде, несущем заместитель. В близких условиях при дегидроциклизации метилциклодекана преобладает образование 1 - и 9-метилдекагидроазуленов. Все эти результаты хорошо объясняются анализом конформацион-ных эффектов названных метилциклоалканов. [29]
Страницы: 1 2