Пространственное расположение - связь
Cтраница 1
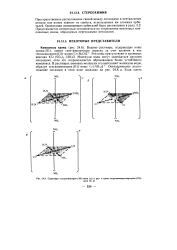 |
Структуры гексаамминхром ( Ш - иона ( а и цис - и гранс-тетраамминдихлорохром ( III. [1] |
Пространственное расположение связей между лигандами и центральным атомом или ионом зависит от свойств, используемых им атомных орби-талей. Ориентация связывающих орбиталей была рассмотрена в разд. Представляется интересным остановиться на стереохимии некоторых комплексных ионов, образуемых переходными металлами. [2]
 |
Схема некоторых реакций никеля. [3] |
Пространственное расположение связей у гидратированцого иона [ Си ( Н2О) 4 ] 2 плоско-квадратное. [4]
Пространственное расположение связей в большинстве молекул и ионов АХ, образованных непереходными элементами ( и переходными элементами в состояниях d, d5 и dl), где X - галоген, О, ОН, NH2 или СН3, может быть определено по общему числу валентных электронов в системе. [5]
Теперь мы рассмотрим пространственное расположение связей, образуемых золотом, серебром и медью в их различных валентных состояниях в связи с электронными структурами этих атомов. [6]
Термин, относящийся к изомерии, возникающей вследствие различий в пространственном расположении связей, без различия между изомерами в характере и кратности связей. [7]
Термин, относящийся в изомерии, возникающей вследствие различав в пространственном расположении связей, без различия между изомерами в характере я краткости связей. [8]
Различие в агрегатном состоянии двуокиси углерода и двуокиси кремния объясняется разным характером и пространственным расположением связей элемент - кислород. В молекуле СО2 атом углерода соединяется с двумя атомами кислорода, образуя с каждым из них одну sp - гибридную ст-связь и одну я-связь. Взаимодействие между линейными и неполярными молекулами двуокиси углерода ограничивается лишь слабыми силами дисперсионного характера. [9]
Если группа М2 несимметрична, то возможны две стерео-изомерные конфигурации каждой мономерной единицы, которые различаются пространственным расположением связей, присоединенных к атому группы М2, входящему в главную цепь. [10]
В 1874 г. Вант-Гофф и Ле-Бель, независимо друг от друга, объяснили причину оптической изомерии пространственным расположением связей углерода. [11]
Немецкий химик Виктор Мейер ( 1848 - 1897) показал, что некоторые типы оптической изомерии, наблюдаемые у азотсодержащих соединений, можно объяснить, лишь допустив пространственное расположение связей азота. [13]
Интересные результаты дают измерения на ориентированных или вытянутых пленках полимеров с применением поляризованного илфра-красного света, в котором электрический вектор колебаний либо параллелен, либо перпендикулярен направлению ориентации; в обоих случаях поглощение получается различным и по отноше - Валентные нию величин поглощения в обоих направлениях ( дихроическое отношение) можно определить пространственное расположение связей в ориентированных участках полимеров. Процессы окисления, термической деструкции, полимеризации, денатурации и другие изменения полимеров, связанные с появлением новых частот или изменением их интенсивности, также могут быть исследованы с помощью инфракрасных спектров поглощения. [14]
В то же время различные салицилаты железа имеют резко различную окраску: FeSal - фиолетовый, FeSal2 - красный, а FeSalg - желтый. Зависимость окраски от числа лигандов указывает на большое значение пространственного расположения связей. Кроме того, большая интенсивность окраски салицилатов железа по сравнению, например, с тартратами указывает на участие электронов ароматического кольца лиганда в образовании хромофорной системы комплекса. [15]
Страницы: 1 2
