Пространственное расположение - связь
Cтраница 2
Различие в агрегатном состоянии диоксида углерода и диоксида кремния объясняется разным характером и пространственным расположением связей элемент - кислород. В молекуле СО2 атом углерода соединяется с двумя атомами кислорода, образуя с каждым из них одну sp - гибридную а-связь и одну л-связь. Взаимодействие между линейными и неполярными молекулами диоксида углерода ограничивается лишь слабыми силами дисперсионного характера. [16]
Общий план данной книги составлен следующим образом. В первой части прежде всего рассматриваются строение атома и силы, действующие между атомами в различных веществах. Далее следует обсуждение размеров атомов и пространственного расположения связей различных типов. После этого приводятся некоторые сведения об агрегатных состояниях вещества и о связи между структурами вещества в различных агрегатных состояниях. Одна глава посвящена более подробному рассмотрению кристаллического состояния. В последней главе первой части упоминаются наиболее важные экспериментальные методы структурной химии. [17]
Известны две группы основных факторов, определяющих цвет красителя в зависимости от его молекулярной и электронной структуры. Первая и основная группа связана с размером и топологией я-электронной системы. Она учитывает число сопряженных атомов и характер пространственного расположения связей между ними - линейный, разветвленный или циклический. [18]
В крахмале, цепь которого образована а-глюкозидными связями, линейные макромолекулы амилозы легко изгибаются. Поэтому гидроксильные группы беспорядочно расположены в пространстве, чем и объясняется растворимость крахмала в воде. Возможности перегибов целлюлозной цепи по глюкозидным связям С-О - С относительно ограничены стерическими затруднениями, связанными с пространственным расположением р-глю-козидных связей. [19]
Число ковалентных связей, которые может образовать атом, ограничено в соответствии с его положением в периодической системе, тогда как число ионных связей в этом отношении, конечно, неограничено. Более того, пространственное расположение ковалентных связей атома часто бывает самым симметричным, в отличие от типичных ионных кристаллов. Эти характерные особенности ковалентных связей не являются, однако, несовместимыми с тем фактом, что они частично имеют ионный характер, так как, если принять, что связь является результатом резонанса между различными электронными конфигурациями системы атомов, то число и пространственное расположение связей должно зависеть от соответствующих орбит даже при резонансе ионных структур. Углы меж ту связями и межатомные расстояния будут рассмотрены в следующей главе. [20]
Например, известно, что электронные облака s - орбиталей являются сферически симметричными, электронные облака трех р-орбиталей вытянуты в трех взаимно перпендикулярных направлениях, a d - и / - орбитали имеют еще более сложное строение электронного облака. Однако у большинства кристаллов в образовании связей принимают участие электроны, располагающиеся на гибридных орбиталях. При этом пространственное расположение связей зависит от того, какие из орбиталей играют доминирующую роль. Например, принято считать, что в случае алмаза один s - электрон может перейти на р-орбиталь, в результате - чего все четыре внешних электрона оказываются неспаренными. При этом, если в случае чистых s - и р-орбиталей три р-орбитали располагаются под прямыми углами друг к другу, а s - орбиталь является ненаправленной, в алмазе образуются четыре гибридные sp - орби-тали, которые направлены к вершинам правильного тетраэдра ( см. фиг. [21]
Например, известно, что электронные облака s - орбиталей являются сферически симметричными, электронные облака трех р-орбиталей вытянуты в трех взаимно перпендикулярных направлениях, a d - и / - орбитали имеют еще более сложное строение электронного облака. Однако у большинства кристаллов в образовании связей принимают участие электроны, располагающиеся на гибридных орбиталях. При этом пространственное расположение связей зависит от того, какие из орбиталей играют доминирующую роль. Например, принято считать, что в случае алмаза один s - электрон может перейти на р-орбиталь, в результате чего все четыре внешних электрона оказываются неспаренными. При этом, если в случае чистых s - и р-орбиталей три р-орбитали располагаются под прямыми углами друг к другу, а s - орбиталь является ненаправленной, в алмазе образуются четыре гибридные sp - орби-тали, которые направлены к вершинам правильного тетраэдра ( см. фиг. [22]
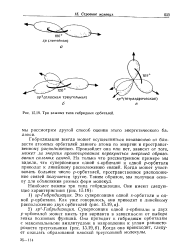 |
Три важных типа гибридных орбнталей. [23] |
Гибридизация всегда может осуществиться независи-мо от близости атомных орбиталей данного атома по энергии и пространственному расположению. Произойдет она или нет, зависит от того, может ли энергия промотирования перекрыться энергией образования сильных связей. На только что рассмотренном примере мы видели, что суперпозиция одной s - орбитали и одной р-орбитали приводит к линейному расположению связей. Когда может участвовать большее число р-орбиталей, пространственное расположение связей получается ipyroe. Таким образом, мы получаем основу для объяснения разных форм молекул. [24]
Атом Fe гемов находится в сопряжении с конъюгированными связями макроцикла. Таким образом, изменение характера сопряжения в макроцикле, как в теме а2, кик варьирование участвующих в сопряжении заместителей в р-пирроле влияют на реакции атома Fe. Это влияние выражается в изменении либо окислительно-восстановительного потенциала ( например, гем а и гем я2) [ Haematin enzymes, J. Другие изменения в свойствах простети-ческой группы тема могут быть вызваны природой и пространственным расположением связей железо-белок. [25]
Свойства веществ определяются массами и зарядами ядер атомов, из которых они построены, пространственным расположением атомных ядер и типом связи, существующим между атомами в молекулах этого вещества. Массы атомов ( за исключением водорода - дейтерия) существенны только для очень немногих свойств веществ, в первую очередь для удельных весов. Большинство свойств зависит в основном только от пространственного расположения атомных ядер и от числа и состояний электронов, которые в конечном счете опять-таки определяются зарядами ядер. Закономерность в расположении атомных ядер в веществе называют его структурой. От структурных данных отличают данные, относящиеся к электронным состояниям молекул ( распределение электронов у различных атомов, характер их взаимодействия или тип связи, пространственное расположение связей); эти результаты рассматривают как данные о строении молекул. [26]
Свойства веществ определяются массами и зарядами ядер атомов, из которых они построены, пространственным расположением атомных ядер и типом связи, существующим между атомами в молекулах этого вещества. Массы атомов ( за исключением водорода - дейтерия) существенны только для очень немногих свойств веществ, в первую очередь для удельных весов. Большинство свойств зависит в основном только от пространственного расположения атомных ядер и от числа и состояний электронов, которые в конечном счете опять-таки определяются зарядами ядер. Расположение атомных ядер в веществе считают его структурой. От структурных данных отличают данные, относящиеся к электронным состояниям молекул ( распределение электронов у различных атомов, характер их взаимодействия или тип связи, пространственное расположение связей); эти результаты рассматривают как данные о строении молекул. [27]
Свойства веществ определяются массами и зарядами ядер атомов, из которых они4 построены, пространственным расположением атомных ядер и типом связи, существующим между атомами в молекулах этого вещества. Массы атомов ( за исключением водорода - дейтерия) существенны только для очень немногих свойств веществ, в первую очередь для удельных весов. Большинство свойств зависит в основном только от пространственного расположения атомных ядер и от числа и состояний электронов, которые в конечном счете опять-таки определяются зарядами ядер. Расположение атомных ядер в веществе считают его структурой. От структурных данных отличают данные, относящиеся к электронным состояниям молекул ( распределение электронов у различных атомов, характер их взаимодействия или тип связи, пространственное расположение связей); эти результаты рассматривают как данные о строении молекул. [28]
Вернер и Иоргенсен синтезировали сотни координационных соединений, главным образом соединений Co ( III), Pt ( IV) и Pt ( Il) с аминами, а также изучили их превращения, СТСГ. В результате интенсивного соперничества между этими двумя замечательными экспериментаторами были быстро сформулированы структурные основы современной координационной химии. Вернер в 1893 г. правильно объяснил свои результаты на основе понятий о первичной и вторичной валентности. Первичная валентность рассматривалась, в сущности, как нормальная электровалентность иона металла [ например, 4 для Pt ( IV), 2 для Pt ( II) и 3 для Со ( П1) ] и определяла общее число отрицательных зарядов, которые должны быть привнесены присутствующими анионами, в то время как вторичная валентность обусловливала пространственное расположение связей вокруг иона металла с образованием октаэдрической [ Со ( III), Pt ( IV) ] или квадратно-плоскостной [ Pt ( II) ] геометрии. Вторичная валентность теперь называется координационным числом. [29]
Страницы: 1 2