Агрегат - молекула
Cтраница 1
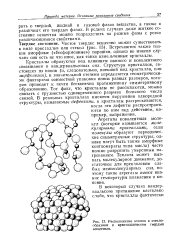 |
Расположение атомов в стеклообразном и кристаллическом твердых веществах. [1] |
Агрегаты ковалеитных молекул ( которые называются молекулярными кристаллами, если молекулы образуют периодические симметричные структуры; однако могут быть также аморфные конгломераты типа масла) часто можно разрушить умеренным нагреванием. Теплота может вызвать молекулярное движение, достаточное для прсочолснпя слабых межмолекулярных сил, поэтому такие arperaibi имеют низкие температуры плавления и кипения. [2]
Агрегаты молекул воды, связанных водородными связями, ориентированы статистически и могут образовать обычную структуру гидрати-рованного иона ОН. [3]
Такой агрегат молекул называют мнпеллой, а момент, когда мицеллы начинают образовываться в большом количестве, является пределом истинной способности мыла растворяться в воде. [4]
Увеличение полярности агрегатов молекул проявляется также в повышении диэлектрической проницаемости жидкостей. [5]
Последние представляют собой агрегаты молекул ( диам. Формируются во внеклеточном пространстве полимеризацией тропоколлагена. [6]
Под зародышем следует понимать минимальный агрегат молекул, обладающий способностью при данном состоянии раствора к дальнейшему росту за счет отложения на его поверхности растворенного вещества в твердом кристаллическом состоянии. [7]
Сферы мезофазы представляют собой агрегаты конденсированных молекул, ориентированных грубо параллельно друг другу и перпендикулярно к поверхности сферы. Молекулы содержат 25 - 30 углеродных атомов, что соответствует 5 - 7 ароматическим кольцам. Химический состав мезофазы и изотропной среды, из которой она растет, весьма близок, однако физические свойства их различны. [8]
Твердые тела представляют собой агрегаты стержнеобразных молекул с кубической плотнейшей упаковкой, как, например, у азота. [9]
Молекулярные кристаллы представляют собой слабо связанные агрегаты молекул, обладающих большой внутренней устойчивостью. Примером молекулярных кристаллов могут служить кристаллы, образованные весьма устойчивыми органическими молекулами. Каталитическая активность кристаллов этого типа мала, так как молекулы, образующие кристаллы, почти полностью насыщены; они неспособны к сильному взаимодействию с адсорбированными молекулами. [10]
Теория, согласно которой свободно связанные агрегаты молекул могут при фильтрации частично разрушаться, а затем восстанавливаться ( процесс обратимости агрегации), проливает новый свет на механизм фильтрации вискозы. [11]
Молекулярный кристалл состоит из агрегата дискретных молекул, удерживающихся силами Ван-дер - Ваальса. Особенность свойств и структуры этих кристаллов легко понять, имея в виду слабое взаимодействие между структурными единицами и тот факт, что действующие силы могут иметь, а могут и не иметь направленного характера. За исключением структур с водородной связью и структур, в которых проявляется диполь-дипольное взаимодействие при очень низких температурах, силы в молекулярных кристаллах, вообще говоря, можно считать ненаправленными. [12]
При этом степень связывания агрегатов молекул полимеров и олигомеров с поверхностью зависит не только от степени покрытия поверхности, но и от структуры раствора, определяемой концентрацией и качеством растворителя, из которого формируется адсорбционный слой. [13]
Коллоидные частицы суспензоидов состоят из агрегатов молекул не растворимых в данной среде соединений. [14]
В золях тастйцы представляют - собой агрегаты молекул, и когда речь идет о молекулярном весе, то величина его М, найденная, например, при измерении осмотического давления или диффузии, значительно больше истинного молекулярного веса вещества Ма, образующего коллоидные частицы. [15]
Страницы: 1 2 3 4