Взаимное расположение - карбоксильная группа
Cтраница 1
Взаимное расположение карбоксильных групп в молекуле сказывается на свойствах соединений, обусловливает их специфичность. При близком расположении карбоксильных групп возможность их взаимодействия увеличивается. Если карбоксильные группы разделены цепью из шести и более атомов углерода, их взаимное влияние сказывается мало. [1]
 |
Физические свойства некоторых кислот. [2] |
Взаимное расположение карбоксильных групп в молекуле сказывается на свойствах соединений. При близком расположении карбоксильных групп возможность их взаимодействия увеличивается. Если карбоксильные группы разделены цепью из шести и более атомов углерода, их взаимное влияние сказывается мало. [3]
Взаимное расположение карбоксильных групп в молекуле сказывается на свойствах соединений, обусловливает их специфичность. При близком расположении карбоксильных групп возможность их взаимодействия увеличивается. Если карбоксильные группы разделены цепью из шести и более атомов углерода, их взаимное влияние сказывается мало. [4]
Влияние взаимного расположения карбоксильных групп проявляется прежде всего в разном отношении дикарбоновых кислот к нагреванию. [5]
Как мы увидим дальше, взаимное расположение карбоксильных групп существенно сказывается на ряде свойств двухосновных кислот. [6]
При качественной оценке кислотности следует учитывать взаимное расположение карбоксильной группы и заместителя. Так, по мере удаления атома хлора от карбоксильной группы в ряду хлормасля-ных кислот - / - эффект галогена постепенно затухает, и кислотность соответственно уменьшается. [7]
Результат нагревания дикарбоновых кислот зависит от взаимного расположения карбоксильных групп в углеродной цепи. [8]
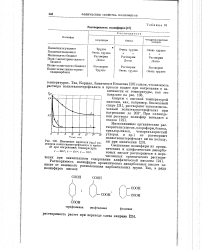 |
Изменение вязкости ( т ] уд растворов полиэтилентерефталата в крезоле при нагревании. температуры. [9] |
Растворимость полиэфиров ароматических дикарбоновых кислот зависит от взаимного расположения карбоксильных групп. [10]
Свойства непредельных кислот, главным образом, определяются взаимным расположением карбоксильной группы и двойной связи. Они дают все реакции карбоксильной группы, образуют соли, сложные эфиры, амиды, ангидриды, галогенангидриды и другие производные, характерные для карбоновых кислот. Кроме этого, они дают и реакции двойной связи, но характер этих реакций зависит от расположения двойной и карбоксильной связей. [11]
 |
Индивидуальные константы скорости гидролиза эфиров полиметакриловой кислоты. [12] |
Малое значение отношения k: k02 в случае атактического полимера свидетельствует о том, что в синдио - и гетеро-триадах взаимное расположение эфирных и карбоксильных групп значительно менее благоприятно для реализации анхимерного содействия, чем в изо-триадах. [13]
Взаимное расположение карбоксильных групп в дикарбоновых кислотах существенно влияет на их химические свойства. Первые гомологи, в которых СООН-группы сближены, - щавелевая и малоновая кислоты - способны при нагревании отщеплять оксид углерода ( 1У), в результате чего удаляется карбоксильная группа. Отсюда этот процесс называется декарбоксилированием. Способность к декарбоксилированию зависит от строения кислоты. Монокарбоновые кислоты теряют карбоксильную группу труднее, только при нагревании их солей с твердыми щелочами. При введении в молекулы кислот электроноакцеп-торных заместителей склонность их к декарбоксилированию возрастает. В щавелевой и малоновой кислотах вторая карбоксильная группа выступает в качестве такого электроноакцептора и тем самым облегчает декарбоксилирование. [14]
Сила двухосновных кислот зависит от взаимного расположения карбоксильных групп в углеродной цепи: чем они более удалены друг от друга, тем кислота слабее. [15]
Страницы: 1 2