Распределение - аминокислота
Cтраница 2
Так как полярные группы, определяющие растворимость аминокислот, одинаковы для различных аминокислот, коэффициенты распределения аминокислот различаются незначительно, и, следовательно, их разделение становится трудной задачей. При ацетидаровании [172] или образовании пипсиль-ных производных ( / г-иодфенилсульфоншшроизводные) [94] фракционирование облегчается за счет уменьшения влияния полярных групп. Хроматографические методы значительно более эффективны по разрешающей способности, но они ограничены возможностью выделения сравнительно небольших количеств веществ. Успешное применение метода противоточного распределения зависит в значительной степени от подходящего выбора двухфазной системы растворителей. Кроме того, применение этого метода ограничивается возможностью разделения веществ низкого молекулярного веса ( 10 000), за исключением тех случаев, когда пептиды обладают большой устойчивостью к денатурации. В присутствии большинства двухфазных систем растворителей, как правило, легко происходит денатурация белков. Однако при нахождении благоприятных условий противоточное распределение-имеет преимущество по сравнению с другими методами, так как при этом возможно рассчитать коэффициенты распределения компонентов, которые могут быть установлены с большой точностью. Профиль кривой распределения дает хороший критерий чистоты вещества. [16]
Из сказанного выше вытекает, что в настоящее время еще невозможно сформулировать какую-либо зависимость между растворимостью белков и их составом или порядком распределения аминокислот в их молекуле. Если интенсивность притяжения между молекулами растворяемого вещества и растворителя превышает взаимное притяжение молекул растворяемого вещества, то должно произойти растворение. Так как диаметр молекул глобулярного белка очень велик, то взаимодействовать друг с другом способны только те группы, которые расположены на поверхности молекулы. К сожалению, наши знания о таком расположении полярных и неполярных групп очень ограниченны. Некоторые сведения о распределении полярных групп можно получить, определяя прирост диэлектрической постоянной при растворении белков ( см. гл. [17]
Построить классификацию белков на основании их химического строения пока еще нельзя, так как до сих пор недостаточно изучено строение молекул многих белков и, в частности, неизвестен порядок распределения аминокислот в белковых молекулах. [18]
Анализы почти 500 образцов древних осадков и природных вод на аминокислоты не выявляют видимого отклонения их содержания в зависимости от геологическоко времени, которое можно использовать для стратиграфических корреляций. Распределение аминокислот в осадках в значительной степени отражает термические условия, которые испытывала порода в ходе геологической истории. Даже спектры метеоритов не очень отличаются от спектров земных мате-риало. Земле, имеют тот же характер, что и аминокислоты, генерированные живыми организмами и сохранившиеся во время биогенного распада. Различаются они только в одном: первые являются рацемическими смесями, тогда как вторые - оптически активными. [19]
В случае смеси двух N-карбоксиангидридов образуется сополимер аминокислот. Распределение аминокислот в цепи при этом оказывается не статистическим, а определяется природой аминокислот. На основе тех же принципов могут быть получены полимеры, состоящие из повторяющихся коротких последовательностей аминокислот. [20]
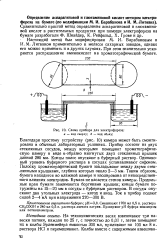 |
Схема прибора для электрофореза. а - вид сверху. б - вид сбоку. [21] |
Настоящий метод был модифицирован М. И. Барабановым и И. М. Литваком применительно к мелассе сахарных заводов, однако его можно применять и в других случаях. При этом значительно ускоряется распределение аминокислот на хроматографической бумаге. [22]
Даже из этих немногих примеров мы видим, что классификация растворимых белков является далеко не совершенной. В настоящее время еще невозможно вывести какую-либо зависимость между растворимостью белков и их составом или порядком распределения аминокислот в их молекуле. [23]
Из восьми неспиральных участков молекулы один содержит карбоксильный конец цепи, а остальные находятся в местах изгибов между прямолинейными сегментами. Число аминокислотных остатков в местах изгибов колеблется от нуля до восьми, причем никакой определенной закономерности в распределении аминокислот на этих участках нет. В одном из мест изгиба два спиральных участка соединены одним-единственным остатком пролина. Данные об областях цепи, соединяющих два спиральных участка, особенно существенны, поскольку эти области определяют ( по крайней мере отчасти) конформацию белковой молекулы. В одном случае между двумя спиральными участками находится только остаток аланина. [24]
Например, на рис. 16 для аланина коэфициент равен с: в. Как показали исследования, разделение веществ при распределительной хроматографии зависит н е от адсорбции ( так как чистая бумага - клетчатка практически не адсорбирует аминокислот), аот распределения аминокислоты между фенолом и водой. Дело в том, что воздушносухая фильтровальная бумага всегда удерживает некоторое количество влаги и, таким образом, играет роль водной колонки. Коэфициент данной аминокислоты ( положение пятна) зависит поэтому от соотношения ее растворимости в феноле к растворимости в воде. Чем больше растворимость в феноле, тем дальше ( ближе к фронту растворителя) отойдет пятно; чем больше растворимость в воде, тем больше аминокислота будет удерживаться влагой, содержащейся в бумаге, и тем меньше будет соответствующий коэфициент. [25]
Уже давно известно, что некоторые аминокислоты появляются в гидролизатах белков ранее, чем другие. Так, например, при гидролизе казеина лейцин отщепляется очень быстро, в то время как отщепление валяна происходит значительно медленнее. Результаты этих исследований показывают, что распределение аминокислот в глобулярных белках далеко не однородно. [26]
Хотя аргинин и синтезируется в ораганизме животных, но в таком ограниченном количестве, что его нехватает для покрытия потребностей при нормальном росте. Остальные аминокислоты, как полагают, синтезируются в животном организме. Их 11: глицин, аланин, норлейцин, серии, цистин, аспарагиновая и глютами-новая кислоты, пролип, оксипролин, тирозин, оксилизин. Однако, такое распределение аминокислот не обязательно для всех животных, глицин, например, для цыплят незаменим. Не доказано также и то, что потребность человека и животных в аминокислотах одна и та же или близка. [27]
Из результатов определения аминокислотного состава фракций аминокислот и фракций пептидов, полученных после гидролиза протофра-дином казеина, альбумина и эластина, можно отметить следующее: после 72-часового протеолиза альбумина во фракции аминокислот не найден гистидин, обнаружено относительно небольшое количество тирозина и много лизина; во фракции аминокислот после 48-часового протеолиза казеина содержится весь полуцистин, очень небольшая часть глицина и полностью отсутствуют аспарагинрвая и глютаминовая кислоты, которые, как известно, образуют с Си2 1 отрицательно заряженные комплексы и потому могут элюироваться не во фракции аминокислот, а в одной из пептидных фракций. После 24-часового действия протофрадина на эластин во фракции аминокислот отсутствовали пролин, треонин, серии, глютаминовая кислота, которые полностью находились во фракции пептидов. Нейтральные аминокислоты с алифатическими цепями ( глицин, аланин, валин), на долю которых в эластине приходится около 70 % общего количества аминокислот, в основном также остаются во фракции пептидов; во фракции аминокислот найдено только около 5 % общего количества глицина, 14 % лизина и 30 % валина. В то же время большая часть тирозина и лизина обнаружена во фракции аминокислот. Такое распределение аминокислот по фракциям, не наблюдавшееся при гидролизе казеина и альбумина сои, по всей вероятности, зависит как от специфичности протеиназ протофрадина, так и от особенностей строения и аминокислотного состава эластина. [28]
Страницы: 1 2