Распределение - электролит
Cтраница 2
Электропроводность ионита при таком распределении электролита, очевидно, будет занижена за счет очень высокого электрического сопротивления промежутков, содержащих почти чистую воду. Начавшееся после размораживания ионита выравнивание концентрации в ионите приводит к увеличению, а затем к стабилизации значения проводимости системы. [16]
Как указывалось выше, неравномерность распределения электролита оказывает влияние на величину измеряемого осмотического давления коллоидного раствора. [17]
Предложено уравнение, устанавливающее зависимость коэффициента распределения электролита от энергий сольватации и коэффициентов активности его ионов. Дано приближенное уравнение для расчета коэффициента распределения электролита. [18]
В настоящей работе рассматривается физическая природа распределения электролита между водно-органическим раствором и ионитом, а также описывается концентрирование примесей электролитов методом обращенной высаливательной хроматографии. [19]
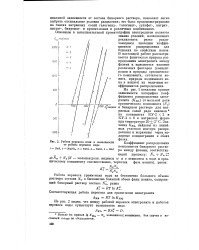 |
Работа переноса соли в зависимости Коэффициент распределения. [20] |
В настоящей работе рассматривается физическая природа распределения электролита между фазами и выясняется влияние различных факторов ( концентрации и природы органического компонента, сетчатости ио-нита, природы подвижного иона в ионите) на величины коэффициентов распределения. [21]
Для большей наглядности в табл. 40 приведено распределение электролита NaCl при различных соотношениях между NaCl и NaR. Из табл. 40 видно, что при C2 / Ci100 хлорид натрия практически поровну распределяется по обе стороны полупроницаемой мембраны. Если соотношение C2 / Ci 0 01, то 99 % хлорида натрия остается в правом отделении и только 1 % его переходит к коллоидному раствору. [22]
В настоящей работе излагается новый метод расчета распределения электролитов между водными ( азотнокислыми) растворами и растворами нейтральных фосфорорганических растворителей в малополярных разбавителях. Метод не требует предварительного определения коэффициентов активности экстрагируемых веществ. [23]
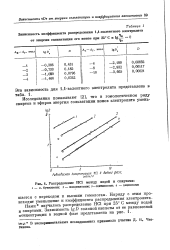 |
Зависимость коэффициента распределения 1 1-валентного электролита.| Распределение НС1 между водой и спиртами. 1 - н. бутиловым. 2 - изоамиловым. з - гептиловым. 4 - децвловым. [24] |
Наряду с этим происходит уменьшение и коэффициента распределения электролита. [25]
Сорбция ионов металлов комплекситами может проходить вследствие доннановского распределения электролита, электровалентного взаимодействия с ионоген-ными группами полимера и комплексообразования с ними. [26]
Установленная в главе VIII количественная связь между коэффициентом распределения электролита ( электролитов) и способностью Компонентов водной фазы к гидратации, выраженная в форме уравнения ( 33), носит ограниченный характер. В первую очередь, следует обратить внимание на тот факт, что при экстракции микроколичеств уранилнитрата зависимости IgD от lg [ ДАМФК ] ( орг. В присутствии в водной фазе азотной кислоты положительные отклонения от идеального ( квадративного) закона распределения уранилнитрата при содержании ДАМФК более 5 - 10 об. % выявляются вполне отчетливо. [27]
Определение активности по коэффициенту распределения применяется для случая распределения электролита между двумя жидкостями, в одной из которых вещества не диссоциируют. [28]
Экспериментальное доказательство применимости закона Бертло - Нернста к распределению электролитов между растворами и кристаллами оказалось довольно трудным. [29]
 |
Схема ячейки электролизера Здан-ского - Лонца. [30] |
Страницы: 1 2 3 4