Распределение - электролит
Cтраница 4
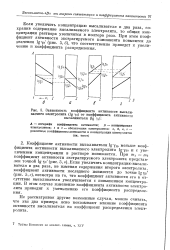 |
Зависимость коэффициента активности высаливаемого электролита ( lg 72 от коэффициента активности высаливателя ( Ig 71. [46] |
Не рассматривая другие возможные случаи, можно считать, что эти два примера ясно показывают влияние коэффициента активности высаливателя на коэффициент распределения электролита. [47]
Электролизер Зданского - Лонца фильтрпрессного типа с биполярным включением электродов имеет внутренние каналы для сбора водорода и кислорода из ячеек и для распределения циркулирующего электролита и питательной воды между ячейками. Проведение процесса под давлением 30 - 40 ат позволяет повысить рабочую температуру электролиза до 110 - 120 С без чрезмерного увеличения количества воды, испаряемой и уносимой газами. В электролизере поддерживается небольшая плотность тока ( 1000 - 1500 а / м2), что в сочетании с высокой рабочей температурой и специальной активацией поверхности электродов позволяет вести процесс при относительно низком напряжении на ячейке ( 1 75 - 1 80 в) и невысоком удельном расходе электроэнергии. [48]
Из уравнения ( 8) вытекает, что с увеличением коэффициента активности электролита в водной фазе и уменьшением его значения в органической коэффициент распределения электролита увеличивается. Значения коэффициентов активности различных электролитов в концентрированных растворах колеблются в широких пределах, и их зависимость от концентрации электролита имеет различный характер. По характеру этих кривых все электролиты могут быть условно разбиты на две группы. К первой относятся электролиты, коэффициенты активности которых значительно увеличиваются с увеличением их концентрации в растворе. К числу таких электролитов относятся НС1, LiCl, MgCb, СаСЬ, SrCla и др. Все они экстрагируются и являются хорошими высали-вателями. [49]
Полученные эмпирические зависимости ( 26), ( 28), ( 32), 33), устанавливающие количественную связь между коэффициентом распределения электролита и способностью компонентов водной фазы к гидратации, являются фундаментальными и в этом отношении стоят в одном ряду с эмпирическими правилами Харнеда и Здановского, уравнением Сеченова и др., причем в отличие от последних уравнения типа ( 26), ( 28), ( 33) не включают параметров, которые не могут быть определены из независимых данных. Применение уравнений типа ( 33) в конечном итоге сводит расчет распределения электролитов в многокомпонентных гетерогенных системах жидкость - жидкость к решению нескольких арифметических задач простейшего вида. Получаемая при этом точность ( см. [1] и ниже) вполне удовлетворительна для любых практических целей. [50]
На основе представлений о концентрационной поляризации, возникающей в системе мембрана - раствор электролита при прохождении через нее постоянного тока, выведено уравнение, описывающее распределение электролита внутри мембраны по толщине для стационарного состояния. Показано, что расчетные профили не являются линейными и удовлетворительно согласуются с экспериментальными. Уравнение позволяет также оценить толщину ппимембоанных диффузионных слоев на основании экспериментальных данных о распределении ллектролита в меморане. [51]
Уравнения этого раздела, выражающие в явном виде зависимость концентрации электролита в ионите от его концентрации в равновесном растворе, могут быть использованы для расчета равновесия распределения электролита, если известны величины Y и Y - Однако, поскольку величина у неизвестна, эти уравнения обычно используются для ее расчета по экспериментальным данным о равновесии распределения. [52]
Экспериментальные данные, отраженные на рис. 41 - 43, подтверждают вывод о том, что наблюдаемая в герметичном аккумуляторе картина распределения емкостей по высоте электродов является результатом поглощения отрицательным электродом кислорода и распределения электролита по высоте аккумулятора. По мнению авторов, описанные явления служат причиной понижения емкости и повышения скорости саморазряда герметичных аккумуляторов. [53]
Для того чтобы интегрировать это уравнение, авторы нашли эмпирические отношения между экспериментально определенными коэффициентами активности и ионной концентрацией, а также измерили осмотический поток, подсчитали его влияние на изменение концентрации внутри мембраны, принимая, что он будет влиять только на распределение электролита, адсорбированного согласно Доннану. Ионная подвижность в фазе смолы была подсчитана из подвижности ионов в свободном растворе с учетом пространственного фактора, основанного на рассмотрении структуры набухшей емолы и содержания в ней воды. [54]
 |
Схема батареи гидразин - перекисьводород-ных ТЭ ( Л. 96 ]. [55] |
ТЭ в блоки, которые затем соединяют последовательно или параллельно. Параллельное распределение электролита может обусловить высокие значения токов утечки. Использование узких капилляров для ввода раствора электролита и реагента в ТЭ позволяет снизить токи утечки. [56]
 |
Схема элемента на основе системы Н2О2 - N2HV. [57] |
Батарею топливных элементов биполярной конструкции собирают последовательно, соединяя отдельные элементы в блоки, которые в свою очередь сочетают последовательно или параллельно. Однако параллельное распределение электролита может обусловить высокие значения силы тока утечки. Для снижения токов утечки используют для ввода раствора электролита и реагента в элементы узкие капилляры. [58]
Страницы: 1 2 3 4