Равновесное распределение - частица
Cтраница 3
Для того чтобы воспользоваться этим законом для вычисления числа активных частиц, имеющих энергию не меньше Е, необходимо сделать допущение, что химическая реакция, протекающая в системе, не нарушает равновесного распределения частиц по энергиям. Это допущение является одной из основных гипотез химической кинетики. Как показывает опыт, для большинства обычных реакций это допущение оправдывается. [31]
Сформулированный выше постулат не выполняется для сильно неоднородных систем, когда приходится оперировать с заметным изменением интенсивных термодинамических величин на расстояниях порядка длины свободного пробега молекул; а также при больших отклонениях от закона равновесного распределения частиц по энергии. [32]
В настоящей работе производится подробное исследование простейшей конфигурации такого типа, а именно, прямого аксиально-симметричного плазменного шнура, удерживаемого магнитным полем текущего вдоль него тока. Равновесное распределение частиц по скоростям предполагается максвелловским, что справедливо, если время удержания шнура в равновесии превышает время между соударениями. Проводимость плазмы считается бесконечной. [33]
Бозе-статистика дает нам ключ к устранению этого парадокса. Когда температура понижается, равновесное распределение частиц стремится к энергетически наиболее выгодному распределению. В этом заключается основное отличие от фермионного газа. В ферми-газе накопление частиц невозможно в силу принципа Паули. Наиболее выгодным энергетическим распределением является такое распределение, когда на каждом из самых низких уровней находится по одной частице. Ни один уровень не имеет макроскопически большого числа заполнения. Подынтегральное выражение в этом уравнении содержит множитель т) 1 / а ( е / & вГ) 1 / 2, следовательно, частицы с нулевой энергией не дают вклада. [34]
Сущность предлагаемого подхода заключается в следующем. Вместо того чтобы искать термодинамически равновесное распределение частиц по размерам, рассматривается бесконечное множество монодисперсных систем и рассчитывается, какая из них обладает минимальным запасом свободной энергии. [35]
Полученное соотношение в значительной степени универсально, но в него входит температура среды. Это связано со статистическим характером установления равновесного распределения частиц по уровням энергии. [36]
При быстрых реакциях в растворах может наблюдаться отклонение от равномерного распределения частиц в пространстве. Наличие молекул растворителя в этом случае обеспечивает равновесное распределение частиц по энергиями, но диффузия реагирующих частиц друг к другу может быть настолько медленной. Между коагуляцией и бимолекулярными реакциями в растворах имеются, однако, и существенные различия. Применимость уравнения диффузии к коагуляции в растворах и к коагуляции достаточно крупных аэрозольных частиц ( с размерами больше длины свободного пробега) не вызывает сомнений. Однако в бимолекулярной реакции линейные размеры зон с обедненной концентрацией реагирующих частиц оказываются сравнимыми с размерами молекулы. Использование уравнения диффузии для такого случая вызывает некоторые возражения. [37]
Ранее было показано, что понятие о температуре органически связано с равновесием. Напомним, что и уравнение Больцмана дает равновесное распределение частиц по энергиям. [38]
Рассмотрим частный случай: пусть внешние силы отсутствуют и достигнуто однородное распределение частиц в пространстве. Система все еще неравновесна, так как не установилось равновесное распределение частиц по скоростям. [39]
Мы видели выше [ см. (7.36) ], что для неоднородной системы в состоянии равновесия химические потенциалы различных частей системы должны быть равны. Это свойство химического потенциала играет большую роль при изучении равновесного распределения частиц во внешнем электрическом, магнитном или гравитационном полях. Конечно, температуры различных частей системы в состоянии теплового равновесия всегда должны быть равны. [40]
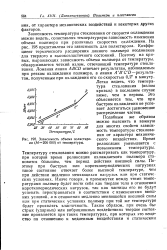 |
Зависимость объема полистирола ( М200 000 от температуры. [41] |
Легко видеть, что температура стеклования ( излом кривых) в последнем случае ниже, чем в первом. Это объясняется тем, что при быстром охлаждении не успевает достигаться равновесное распределение частиц. [42]
Плазмохимические процессы условно можно разделить на две группы: квазиравновесные и неравновесные [ 3; с. Химическая реакция, являющаяся по своему существу неравновесным процессом, не вносит существенных изменений в равновесное распределение частиц по энергиям. В системе сохраняется практически невозмущенное МБ-распределение частиц по энергиям и скорости. [43]
Активированный комплекс можно ( условно) считать находящимся в равновесии с исходными молекулами, если химическая реакция не нарушает максвелл-бодьцмановского распределения частиц по энергиям. Для этого реакция должна протекать достаточно медленно, значительно медленнее, чем в системе достигается равновесное распределение частиц по энергиям. [44]
Для частиц достаточно малого размера, у которых склонность к седиментации выражена слабее, а коэффициент диффузии - выше, седиментации противостоит стремление к равномерному распределению частиц по высоте вследствие броуновского движения. Если между процессами седиментации и диффузии наступает равновесие - седиментационно-диффузионное равновесие, то устанавливается и определенное равновесное распределение частиц по высоте. [45]
Страницы: 1 2 3 4