Распространенность - изотоп
Cтраница 3
В масс-спектрометрии для определения распространенности изотопов используются два метода: абсолютный и относительный. [31]
Анализ микропримесей или определение распространенностей редких изотопов связаны с измерением ионных токов, интенсивность которых изменяется в широком диапазоне. Для выходных токов, больших 10 8 а, в умножителях наблюдается эффект усталости: при настройке на интенсивный ионный пучок выходной сигнал на регистраторе падает по сравнению с его первоначальным значением. Чувствительность восстанавливается через несколько минут после выключения ионного пучка. При регистрации токов, резко различающихся по интенсивности, возникают специальные проблемы в конструкции усилителя, стоящем после умножителя. Поэтому в ряде случаев предпочтительнее использовать двойную регистрирующую систему: интенсивные пучки измеряются усилителями постоянного тока, слабые - умножителями. При этом в процессе работы необходимо определить усиление умножителя. Высокая чувствительность особенно необходима при исследовании образцов, обладающих низкой упругостью пара и разлагающихся при повышении температуры, когда необходимо исследовать образец при возможно более низкой температуре. Таким образом он обеспечивает возможность работы при низких температурах и с малолетучими веществами. [32]
 |
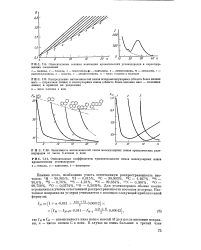
Сравнение рассчитанных и наблюдаемых распространенностей ядер с массовыми числами А 20 - 60. [33] |
Сплошными линиями для наглядности соединены распространенности изотопов одного и того же элемента. [34]
Отмеченная закономерность характерна и для распространенности изотопов элементов. [35]
 |
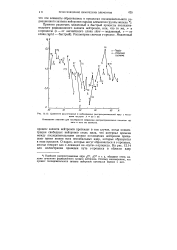
Масс-спектр препарата лютеция и европия ( оксалаты. [36] |
Напряжение приложенного тока является мерой распространенности изотопов в исследуемом веществе. [37]
Большое внимание уделено методике определения распространенности изотопов и количественному анализу отдельных компонент в смесях газообразных, жидких и твердых веществ. [38]
В качестве примера точности определения распространенности изотопов ( даже при отсутствии двойного коллектора) рассмотрим результаты анализа образцов СО2, полученные в нашей лаборатории. Двуокись углерода была получена при сжигании пенициллина - G, обогащенного 13С, N-этил-гексаме - тилениминового производного этого пенициллина и необогащенного пенициллина - G. Так как пенициллин - G содержит 16 углеродных атомов, а его производное-24, то степень обогащения в образцах двуокиси углерода, полученных из этих соединений, должна соответствовать 3: 2; это обеспечивает контроль точности результатов. [39]
В табл. 59 представлены массы и распространенность изотопов водорода и кислорода. Поскольку и водород и кислород являются относительно легкими атомами, изменение изотопного состава молекулы перекиси водорода сравнительно сильно изменяет ее молекулярный вес. Однако в связи с тем, что тяжелые изотопы присутствуют в природе лишь в очень малых относительных количествах, необходимо во много раз обогатить пробу естественной перекиси водорода тяжелыми изотопами, чтобы средний молекулярный вес смеси заметно повысился. Возможность такого обогащения в процессе производства ( например, при электролизе или перегонке), по-видимому, ничтожно мала. [40]
Нх и Нет - относит, распространенность изотопов данного элемента соотв. Величина 8 может быть измерена с более высокой точностью, чем абс. Относит, стандартное отклонение достигает 0 005 - 0 01 % для С, Nj, Oi S в газовой фазе и 0 03 - 0 05 % для На п для элементов в твердой фазе. Кол-во в-ва, необходимое для анализа в газовой фазе, составляет обычно ( ОД - 0 5) - 10 моль. [41]
В расчетах точных значений масс и распространенностей изотопов при составлении таблицы органических соединений необходимо, как указывалось в гл. В органических соединениях чаще всего встречаются четыре элемента: углерод, водород, кислород и азот, и с точки зрения поставленной задачи желательно ограничить наши расчеты распространенностей изотопов такими молекулярными и осколочными ионами, которые не содержат иных атомов, кроме перечисленных выше. Далее было принято, что все рассматриваемые комбинации атомов должны ( за небольшими исключениями, такими, как CN, Н2О, NH3) всегда содержать углерод и водород и не должны включать в себя больше шести атомов кислорода и азота или не больше четырех атомов каждого из этих элементов в отдельности. Верхний предел рассматриваемых молекулярных весов составлял 250, поскольку в этот диапазон включены наряду с углеводородными и неуглеводородные соединения, а относительное различие в распро-страненностях изотопов различных комбинаций элементов становится менее заметным с увеличением молекулярного веса. Максимальное число водородных атомов, включаемых в любую комбинацию углерода, кислорода и азота, должно удовлетворять всем требованиям валентности для расположения элементов, не содержащих колец или кратных связей. Несколько исключений из этого правила относятся к положительным ионам, встречающимся на практике, таким, как СН, Н3О, CHSO и тому подобным. В рассмотрение не включены многозарядные ионы, но следует принимать во внимание, что иногда они могут встречаться. К двузарядным могут быть отнесены ионы, пики которых по шкале масс отстоят от соседних на 0 5 а. В таких случаях, для определения состава иона измеряемая масса должна быть удвоена, и в таблице следует найти эту удвоенную величину, отвечающую наблюденному иону. [42]
Для углеводородов обычно можно ограничиться учетом естественной распространенности изотопов углерода. [44]
Изучение закономерностей в составе, свойствах и распространенности изотопов различных элементов позволяет уже сейчас установить, что, помимо периодов химических ( число которых пока равно 7), имеются периоды физические, обусловленные повторяемостью особенностей в строении изотопных плеяд. [45]
Страницы: 1 2 3 4