Рассмотрение - электронная структура
Cтраница 2
АО, комплексные или вещественные, целесообразнее использовать при рассмотрении электронной структуры атома. [16]
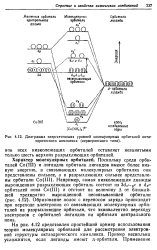 |
Диаграмма энергетических уровней молекулярных орбиталей окта-эдрического комплекса ( вернеровского типа. [17] |
На рис. 4.12 представлен простейший пример использования теории молекулярных орбиталей для рассмотрения электронной структуры октаэдрического комплекса. Пример несколько усложнится, если лиганды имеют я-орбитали. [18]
С точки зрения химика данная выше физическая картина фотохимического разложения должна быть дополнена рассмотрением электронных структур и химических свойств непосредственных продуктов разложения. Фотохимические реакции требуют обычно больше энергии, чем соответствующие химические процессы. [19]
Таким образом, результаты проведенного анализа спектров поглощения медных хелатов салицилальалкилиминов, основанного на рассмотрении электронной структуры хелатной молекулы как единой d, л-сопря-женной системы, достаточно хорошо согласуются с экспериментальными данными. [20]
В целом следует все же подчеркнуть, что отсутствие достаточно строгой теории металлической связи делает рассмотрение электронных структур и обсуждение характера связи на основе ЯГР-спектров в основном качественным. [21]
В предыдущих главах было показано, что энергии ионизации, сродство к электрону и электроотрицательности атомов всех элементов удается объяснить на основе рассмотрения орбитальной электронной структуры атомов. [22]
Расщепление серного кольца может, по данным Кребса [145], как правило, происходить двумя путями, как это легко можно себе представить при рассмотрении электронной структуры 88-цикла. С одной стороны, при раскрытии цикла электронная пара может остаться у одного атома серы; в таком случае на другом конце образовавшейся 88-цепи создается недостаток электронов, с другой стороны, - каждый из концевых атомов серы может присоединить один электрон. [23]
 |
Схема образования связывающей as и разрыхляющей cr молекулярных орбиталей при перекрывании атомных орбиталей. [24] |
Описать молекулу согласно теории МО - это значит определить тип ее орбиталей, их энергию и выяснить характер распределения электронов по орбиталям, т.е. решить те же задачи, что и при рассмотрении электронных структур атомов. [25]
Сходство основных термов азота и окиси углерода, существующее несмотря на различие состояний атомов, из которых они возникают или на которые они диссоциируют, указывает на то, что главным фактором, определяющим структуру основного состояния молекулы, является полное число электронов в молекуле. Справедливость этого утверждения, по крайней мере для двухатомных молекул, атомы которых не очень сильно отличаются друг от друга, будет показана в дальнейшем при рассмотрении электронной структуры других молекул. [26]
Современная химия, имеющая дело с колоссальным числом веществ, создает великое множество самых разнообразных геометрических форм. Каждая молекула отличается не только числом и видом входящих в нее атомов, но и симметрией своего ядерного остова - ядерного полиэдра, которую необходимо учитывать при рассмотрении электронной структуры молекулы. [27]
На протяжении всей этой книги постоянно подчеркиваются взаимосвязи между свойствами элементов и их соединений, которые являются неотъемлемой чертой систематики элементов в периодической таблице. Закономерности, наблюдающиеся в рядах, подчеркивались при рассмотрении электронной структуры, относительной электроотрицательности и образования химических связей; для того чтобы показать, как изменяются те или иные свойства в зависимости от порядкового номера, использовались многочисленные графические изображения. [28]
Описание этих методов выходит за рамки данной книги. За последние сорок лет были определены длины связей для многих сотен веществ, и полученные значения оказались весьма полезными при рассмотрении электронных структур молекул и кристаллов. [29]
Чаще встречаются оболочки из 12 электронов, to есть шести-ковалентные соединения. Сюда относятся комплексные соли железа, никеля, кобальта, платины. Казалось, что комплексные соединения металлов не подчиняются законам валентности. При замещении атома или радикала во, внутренней сфере на молекулу изменяется заряд внутренней сферы и число ионов во внешней сфере. Эти явления становятся понятными при рассмотрении электронных структур комплексных соединений. [30]
Страницы: 1 2