Дикарбид
Cтраница 3
Однако, как видно из табл. 11, механизм перехода этих окислов в газовую фазу по реакциям (2.9) и (2.10) будет лимитироваться процессом термической диссоциации дикарбидов РЗЭ. В дальнейшем при повышении температуры все более увеличивается вероятность протекания реакции образования и диссоциации дикарбидов. Для всех окислов РЗЭ, за исключением La2O3, в интервале температур 1000 - 2000 К термическая диссоциация по реакциям (2.5) и (2.6) практически не влияет на скорость поступления металлов РЗЭ в газовую фазу. Лишь при 2000 К и выше реакция (2.5) для La2O3 может давать заметный вклад в общий поток компонентов, поступающих в газовую фазу. В условиях нашего эксперимента и опытов Ашара при наличии углерода для всех исследуемых окислов РЗЭ реакции (2.6) и (2.7) существенного значения не имеют. [31]
Показано, что при 1000 - 1500 К переход окислов самария, европия и иттербия в газовую фазу при наличии восстановительной среды - углерода протекает по реакции восстановления до металла. С возрастанием температуры до 2000 К все большую роль для этих окислов будет играть механизм перехода в газ через дикарбиды. [32]
Карбиды получают взаимодействием У. Монокарбид UC кристаллизуется в гранецентрирован-ной кубич. Дикарбид иС - в тетрагональной решетке ( а 3 517 А, с 5 987 А), плотн. [33]
Это - соединения с графитоподобными решетками, в к-рых атомы металлов расположены между слоями из атомов углерода. Дикарбиды щелочноземельных металлов кристаллизуются в тетрагональной решетке типа СаС2 с изолированными парами из атомов углерода, у них высокое удельное электрическое сопротивление. При нагревании в вакууме диссоциируют на металл и углерод. Стойкий в вакууме до т-ры 1200 С, при т-ре 2200 С возгоняется без плавления. Легко разлагается водой с выделением метана. Удельное электрическое сопротивление около 10 - 6 мком - см. К. [34]
Появление второй ( дикарбидной) фазы в карбидных сплавах нежелательно, так как оно приводит к ослаблению прочности связи углерода и снижению радиационной стойкости. Твердый раствор UC и кубического UC2 распадается при температуре ниже 2100 С на исходные компоненты, а ниже 1780 С - на смесь UC и тетрагонального UCa, которая существует в узком интервале 1780 - 1730 С. Выше 1765 С существует кубический дикарбид a - UC2, а ниже этой температуры - тетрагональный дикар-бид P - UC2, который распадается при 1500 С на l Cs и углерод. [35]
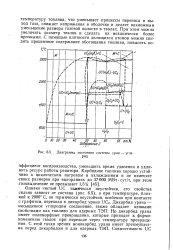 |
Диаграмма состояния системы уран - углерод. [36] |
Дикарбид урана - насыщенное углеродом соединение, также обладает ценными свойствами как топливо для ядерных ТЭП. Но дикарбид урана имеет полиморфные превращения, которые приводят к формоизменению твэлов при переходе через температуру превращения. С этой точки зрения монокарбид урана имеет преимущества перед дикарбидом и для ядерных ТЭП. [37]
Этин, ацетилен ( CH CiH), - это бесцветный газ, в чистом виде без запаха, технический - с неприятным запахом. В отличие от этана и этена этин немного растворим в воде и хорошо растворяется в ацетоне. Так как сам ацетилен при сжатии взрывается, а его раствор в ацетоне - нет, то транспортировка проводится в стальных баллонах, содержащих пористый материал, пропитанный упомянутым раствором. С воздухом ацетилен образует взрывчатую смесь. Чистый ацетилен горит желтым коптящим пламенем, потому что при горении высвобождается большое количество сажи из-за высокого процентного содержания углерода в молекулах ацетилена. В промышленности ацетилен получают гидролизом дикарбида кальция ( СаС2), полученного сплавлением кокса с оксидом кальция, либо частичным окислением или гидролизом метана или низших алканов. [38]
Страницы: 1 2 3