Термодинамическое рассмотрение
Cтраница 2
Термодинамическое рассмотрение действия ферментов включает либо уменьшение энергии активации, либо увеличение изменения энтропии, когда реакция идет по пути, катализируемому ферментами. [16]
Термодинамическое рассмотрение адсорбционных равновесий на пористых и высокодисперсных адсорбентах неизбежно включает в себя термодинамику искривленных поверхностей. [17]
Термодинамическое рассмотрение идеального процесса горения в двигателе, работающем по циклу Отто, показывает, что коэфициент полезного действия цикла увеличивается с увеличением степени сжатия, а мощность растет с увеличением плотности всасываемого заряда, то есть с увеличением наддува. Предел увеличения обоих этих параметров обусловлен появлением детонации, которую обнаруживают по металлическому стуку, слышимому при горении. [18]
Термодинамическое рассмотрение свойств сплавов Ni-Си [64] показало, что при низких температурах отжига сплав расслаивается и на поверхности имеется фаза, богатая медью, состав которой в широком интервале концентраций не зави-сит от суммарного состава образца. [19]
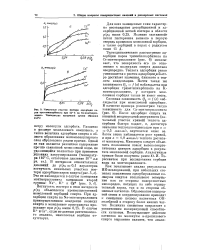 |
Начальные участки изотерм адсорбции паров триметнлкарбпнола прп 25 С на Cs-монтморил-лонитс. Температура вакуумной сушки образцов 110 С. [20] |
Термодинамическое рассмотрение адсорбции паров триметилкарбинола на Cs-монтмориллоните ( рис. 6) показывает, что поверхность его по отношению к молекулам спирта довольно неоднородна. Теплота адсорбции резко уменьшается с ростом адсорбции быстро достигает значения, близкого к теплоте конденсации. Почти такая же зависимость Qa / ( а) наблюдается при адсорбции триметилкарбинола на К-монтмориллоните, у которого межслоевая сорбция также не имеет места. [21]
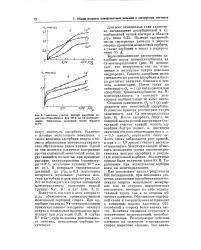 |
Начальные участки изотерм адсорбции паров триметилкарбинола при 25 С на Cs-монтморил-лоните. Температура вакуумной сушки образцов 110 С. [22] |
Термодинамическое рассмотрение адсорбции паров триметилкарбинола на Cs-монтмориллоните ( рис. 6) показывает, что поверхность его по отношению к молекулам спирта довольно неоднородна. Теплота адсорбции резко уменьшается с ростом адсорбции и быстро достигает значения, близкого к теплоте конденсации. Почти такая же зависимость Qa / ( а) наблюдается при адсорбции триметилкарбинола на К-монтмориллоните, у которого межслоевая сорбция также не имеет места. Сложная зависимость Qa / ( а) наблюдается при межслоевой адсорбции. После адсорбции спирта на внешней неоднородной поверхности ( начальный участок кривой) теплота адсорбции быстро падает, и, достигнув значения теплоты конденсации при а 0 5 ммолъ / г, опускается ниже ее. Затем вновь наблюдается рост кривой, и при а 1 8 ммолъ / г теплота достигает максимума. Максимум следует объяснить появлением новых высокоэнергетических центров адсорбции в результате межслоевой сорбции. [23]
Термодинамическое рассмотрение адсорбции паров триметилкарбинола на Cs-монтмориллоните ( рис. 6) показывает, что поверхность его по отношению к молекулам спирта довольно неоднородна. Теплота адсорбции резко уменьшается с ростом адсорбции и быстро достигает значения, близкого к теплоте конденсации. Почти такая же зависимость Qa / ( а) наблюдается при адсорбции триметилкарбинола на К-монтмориллоните, у которого межслоевая сорбция также не имеет места. [24]
Более полное термодинамическое рассмотрение равновесия требует учета поверхностной энергии и энергии внутренних напряжений, возникающих при фазовых превращениях. Эти факторы находят отражение в диаграммах равновесных состояний и приводят к смещению фазовых границ и явлениям температурного гистерезиса. [25]
Термодинамическое рассмотрение возникновения зародышей новой фазы в макроскопической системе, находящейся в метаста-бильном состоянии, показывает, что для различных фазовых переходов и при разных условиях зародышеобразования ( гомогенное или гетерогенное) существует энергетический барьер, препятствующий появлению зародышей. Возникновение зародышей может рассматриваться при этом как флуктуационный процесс преодоления системой энергетического барьера. [26]
IV термодинамическое рассмотрение позволило выделить два больших класса дисперсных систем: термодинамически устойчивые - лиофильные системы и устойчивые лишь кинетически - лиофобные системы. Анализу строения, условий разрушения и устойчивости лиофобных систем посвящены следующие главы книги; в данной главе подробно рассмотрены условия образования лиофильных коллоидных систем, их строение и свойства. [27]
Однако термодинамическое рассмотрение не дает нам возможности установить, насколько каждый реальный случай близок к оптимальным условиям ( то есть к термодинамически обратимому процессу), какую силу тока может дать элемент и какова будет действительная мощность источника энергии. Сила тока определяется скоростью химического процесса генерации тока. Вопросы, связанные со скоростью химических реакций, выходят за рамки термодинамического рассмотрения и относятся к области кинетики реакций. Эта наука пока еще не располагает достаточной базой знаний, в ней отсутствуют фундаментальные положения, подобные двум началам термодинамики. Поэтому изучение процессов, происходящих в гальванических элементах, на основании кинетики реакций представляет значительную сложность. [28]
Однако формальное термодинамическое рассмотрение таких систем, выполненное, например, в работах Овербика и Воорна [3, 4], описывало только следствие реакции ( VII. Pn Q - в отдельную фазу - коацерват, а собственно химическая реакция ( VI 1.1) оставалась практически вне рассмотрения. [29]
Проведем термодинамическое рассмотрение совокупности равновесных реакций, приводящих к образованию комплексных соединений в окислительно-восстановительной системе, которая состоит из катионов металла в разных степенях окисления. Окислительно-восстановительная система помещена в водном растворе кислоты НЬА. [30]
Страницы: 1 2 3 4