Раствор - иодид - натрий
Cтраница 2
На рис. 11.6 даны кривые титрования триэтилентетрамина в воде и в 8 М растворе иодида натрия. Первый изгиб на кри-тзой водного титрования соответствует нейтрализации двух аминогрупп, второй изгиб - нейтрализации трех аминогрупп. Четвертая группа обладает слишком слабыми основными свойствами ( 41.10 - 12) и не может быть оттитрована в воде. При титровании в SM растворе иодида натрия наблюдаются три перегиба, соответствующих нейтрализации двух, трех и четырех аминогрупп. [16]
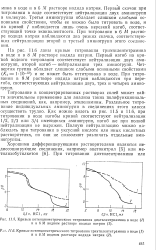 |
Кривые потенциометрического титрования диэтилентриамина в воде ( /.| Кривые потенциометрического титрования триэтилентетрамина в воде ( /. [17] |
На рис. 11.6 даны кривые титрования триэтилентетрамина в воде и в 8 М растворе иодида натрия. Первый изгиб на кри-тзой водного титрования соответствует нейтрализации двух аминогрупп, второй изгиб - нейтрализации трех аминогрупп. Четвертая группа обладает слишком слабыми основными свойствами ( / ( 4 Ы ( Н2) и не может быть оттитрована в воде. При титровании в SM растворе иодида натрия наблюдаются три перегиба, соответствующих нейтрализации двух, трех и четырех аминогрупп. [18]
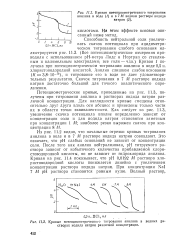 |
Кривая потенциометрического титрования анилина в воде ( / и в 7 М водном растворе иодида.| Кривые потенциометрического титрования анилина в водных растворах иодида натрия различной концентрации. [19] |
Потенциометрические кривые, приведенные на рис. 11.3, получены при титровании анилина в растворах иодида натрия различной концентрации. Для наглядности кривые смещены относительно друг друга вдоль оси абсцисс и приведены только части их в области точки эквивалентности. [20]
К капле анализируемого слабокислого раствора на капельной пластинке прибавляют каплю раствора нитрата висмута и каплю раствора иодида натрия. В присутствии иона Т1 появляется красный осадок. [21]
Из рис. 11.2 видно, что начальные отрезки кривых титрования анилина в воде и в 7 М растворе иодида натрия совпадают. Это означает, что рН слабых оснований не зависит от концентрации соли. После того как анилин нейтрализован, рН титруемого раствора зависит от избыточного количества прибавляемой хлористоводородной кислоты, но не зависит от гидрохлорида анилина. Кривая на рис. 11.4 показывает, что рН 0 0192 М раствора хлористоводородной кислоты понижается линейно с увеличением концентрации раствора иодида натрия. При концентрации Nal 1 М рН раствора становится равным нулю. [22]
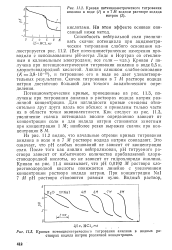 |
Кривая потенциометрического титрования анилина в воде ( / и в 7 М водном растворе иодида.| Кривые потенциометрического титрования анилина в водных растворах иодида натрия различной концентрации. [23] |
Из рис. 11.2 видно, что начальные отрезки кривых титрования анилина в воде и в 7 М растворе иодида натрия совпадают. Это означает, что рН слабых оснований не зависит от концентрации соли. После того как анилин нейтрализован, рН титруемого раствора зависит от избыточного количества прибавляемой хлористоводородной кислоты, но не зависит от гидрохлорида анилина. Кривая на рис. 11.4 показывает, что рН 0 0192 М раствора хлористоводородной кислоты понижается линейно с увеличением концентрации раствора иодида натрия. При концентрации Nal 7 М рН раствора становится равным нулю. [24]
В пробирки с раствором бромида и иодида натрия внести по 3 - 4 капли хлорной воды, а в пробирку с раствором иодида натрия - столько же бромной воды. По окраске полученного слоя органического растворителя установить, какой галоген выделяется в свободном виде в каждой из пробирок. [25]
К подкисленному раствору, содержащему 0 543 г некоторой соли, в состав которой входят литий, хлор и кислород, добавили раствор иодида натрия до прекращения выделения иода. Масса образовавшегося иода равна 4 57 г. Установите формулу соли. На сколько процентов уменьшится масса твердого вещества при полном термическом разложении исходной соли. [26]
О-аце-тил - О-глюкозы [2] или 6 - О-тозил - 1 2 3 4-тетра - О-ацетил - 1) - глю-козы [3] с раствором иодида натрия в ацетоне. [27]
Однако следует заметить, что а-галогенкетоны, сложные эфиры, амиды и нитрилы весьма реакционноспособны по отношению к иодид-иону и при обработке раствором иодида натрия в ацетоне при 25 С уже через 3 мин дают осадок га-логенида натрия. [28]
Можно было бы предполагать, что объемистые заместители в трифенилметилхлориде будут препятствовать реакции замещения иодид-ионом, однако в действительности это соединение реагирует с раствором иодида натрия в ацетоне значительно быстрее, чем бензилхлорид. При проведении этой реакции наблюдается выделение свободного иода. Следовательно, она не является простой реакцией замещения с образованием третичного иодида. Этот пример показывает, что при истолковании результатов качественных реакций такого типа необходимо соблюдать осторожность. Следует помнить, что некоторые представители изучаемого класса соединений могут реагировать с применяемым реагентом нестандартно и что влияние одних и тех же структурных факторов на реакционную способность может быть совершенно различным в зависимости от типа реакции. [29]
Принцип действия прибора основан на вытеснении иода озо-из раствора иодида натрия в одном канале и поглощении иода сернистым ангидридом в другом канале при непрерывной электрохимической генерации иода и раствора иодида натрия. [30]
Страницы: 1 2 3 4