Раствор - иодид - натрий
Cтраница 3
К анализируемому раствору ( смесь растворов солей индия и кадмия) прибавляют 1 мл 0 1 % - ного раствора желатины и разбавляют до 25 мл 3 М раствором иодида натрия. Измеряют высоту волны индия hx, затем прибавляют в электролизер пипеткой 1 мл стандартного раствора индия, перемешивают и снова снимают полярограмму. [31]
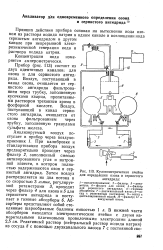 |
Кулонометрическая ячейка. [32] |
Принцип действия прибора основан на вытеснении иода озоном из раствора иодида натрия в одном канале и поглощении иода сернистым ангидридом в другом канале при непрерывной электрохимической генерации иода и раствора иодида натрия. [33]
Иод-6 - дезокси-1 2 3 4-тетра - О-ацетил - О-глю-козу получают кипячением 6-бром - 6-дезокси - 1 2 3 4-тетра - О-аце-тил - Д - глюкозы [2] или 6 - О-тозил - 1 2 3 4-тетра - О-ацетил - 1) - глю-козы [3] с раствором иодида натрия в ацетоне. [34]
Раствор иодида натрия добавляют до полного растворения осадка. Затем через обычную воронку с помощью стеклянной палочки переливают активный раствор в мерную колбу на 50 мл, доливают водой до метки и тщательно перемешивают. Из полученного раствора с помощью пипетки со шприцем отбирают в два стакана по две параллельные пробы раствора по 10 мл. Обработку каждой пробы проводят идентично. [35]
Были измерены электропроводности растворов галогенидов лития, натрия, калия и рубидия. Удельная электропроводность растворов иодида натрия ниже, чем удельные электропроводности растворов других соединений, и с изменением концентрации изменяется незначительно. Удельные электропроводности растворов трех остальных иодидов резко возрастают с повышением концентрации, достигая максимума приблизительно при 10 мол. Как сообщается, удельная электропроводность растворов иодида натрия уменьшается, а растворов иодидов лития, калия и рубидия, увеличивается с ростом температуры. Ясно, что в таких растворах присутствуют ассоцпаты - тройники и более сложные ионы, а также ионы М и Ijj. По-видимому, нецелесообразно пытаться более глубоко судить о природе растворов иодидов в иоде до тех пор, пока не подтверждены аномальные свойства растворов иодида натрия и не проведено более детальное изучение этих растворов. [36]
Иодиды получают из хлоридов или бромидов, используя тот факт, что иодид натрия растворим в ацетоне, а хлорид и бромид натрия не растворимы. При обработке алкилхло-рида или алкилбромида раствором иодида натрия в ацетоне равновесие смещается вследствие выпадения в осадок хлорида или бромида натрия. Поскольку здесь действует механизм Sw2, то для первичных галогенидов реакция идет лучше, чем для вторичных и третичных. Раствор иодида натрия в ацетоне часто применяют в тесте на первичные бромиды или хлориды. [37]
Поскольку, как показано ниже, бензильный и аллильные карбокатионы способны к резонансной стабилизации, то не удивительно, что оин реагируют с нитратом серебра быстрее, чем соответствующие насыщенные галогениды. Бензил - и аллилгалогениды активны также и по отношению к раствору иодида натрия в ацетоне. [38]
Ранее нами было установлено [5], что обычный активный уголь, проявляющий в основном анионообменные свойства, хорошо поглощает из галоидных солей отрицательно заряженные ионы свинца и цинка. Из растворов хлорида и бромида натрия примеси кальция, алюминия и никеля сорбируются в незначительной степени, однако в растворах иодида натрия происходит резкое увеличение поглощения катионов этих металлов. Свойство галоидных ионов поляризоваться усиливается с переходом от хлорид - к иодид-ионам, и вместе с тем возрастает их способность поглощаться углем с одновременным захватом примесей. В отличие от обычного активного угля для окисленного не наблюдается столь резкого различия в сорбируемости примесей при переходе от хлоридных растворов к иодид-ным. [39]
В каменных метеоритах хром определяют из отдельной навески после сплавления образцов с Na202 и выщелачивания плава водой. Железные метеориты растворяют в 8 Ж HN03 или 8 М H2S04 и хром определяют радиохимическим нейтронно-активационным методом [1051], фотометрически или титрованием раствором иодида натрия. [40]
Анализируемый раствор, содержащий смесь - 0 3 г иодида и - 0 2 г бромида натрия, помещают в колбу емкостью 50 мл и доводят до метки дистиллированной водой. В два стакана емкостью 100 мл берут пипеткой две пробы точно по 10 мл и в каждый добавляют пипеткой со шприцем по 1 мл раствора иодида натрия, содержащего 1311 с точно известной удельной радиоактивностью 5000 имп / ( мин-мл) без носителя, 2 мл концентрированного раствора аммиака и разбавляют растворы 10 мл воды. Если удельная радиоактивность раствора неизвестна, то в третий стакан из бюретки наливают 6 мл 0 05 М раствора неактивного иодида натрия, пипеткой со шприцем вводят 1 мл радиоактивного раствора, 2 мл концентрированного раствора аммиака и также разбавляют 10 мл дистиллированной воды. Затем проводят частичное осаждение иодида серебра в двух первых и полное - в последнем стакане добавлением из бюретки при помешивании в первом случае 4 мл 0 05 М раствора AgNO3, а во втором случае - 6 мл того же раствора. Чтобы избежать выделения свободного иода, к раствору перед кипячением добавляют несколько кристалликов сульфита натрия. Осадки количественно переносят посредством холодного 0 01 М раствора HNO3 на плотный фильтр, в специальной воронке для приготовления осадков для измерения, промывают небольшим количеством дистиллированной воды и спиртом или ацетоном, сушат на воронке при открытом водоструйном насосе, закрыв воронку крышкой от тигля для предохранения от разложения осадка под действием света. Радиоактивность осадков на фильтре измеряют на счетчике в течение такого времени, чтобы число подсчитанных импульсов равнялось 3 - 5 тысячам. [41]
Для анализа а-моноалкильных производных пользуются модифицированным способом. К исследуемому спиртовому раствору прибавляют избыточное количество спиртового раствора брома известной концентрации и не вошедший в реакцию бром определяют титрованием иода, моментально выделяющегося на холоду после прибавления раствора иодида натрия. [42]
Для анализа о-мопоалкнльных производных пользуются модифицированным способом. К исследуемому спиртовому раствору прибавляют избыточное количество спиртового раствора брома известной концентрации и не вошедший в реакцию бром определяют титрованием иода, моментально выделяющегося на холоду после прибавления раствора иодида натрия. Количество брома, поглощенного енолом, и соответственно содержание енола вычисляют но разности между количествами прибавленного и не вошедшего в реакцию брома. [43]
Прозрачный раствор должен иметь слабощелочную реакцию по фенолфталеину. В противном случае добавляют еще немного соды и вновь кипятят. Раствор иодида натрия отфильтровывают, упаривают до появления кристаллической пленки и охлаждают. Образовавшиеся кристаллы отсасывают и высушивают в сушильном шкафу при 100 - 110 С. [44]
При обработке концентрированной бромистоводородной кислотой вещество А превращается в два соединения. Одно из них, растворимое во всех растворителях, содержит бром. При действии на это вещество раствора иодида натрия в ацетоне выпадает осадок. Эквиваленты нейтрализации соединений А н Б равны 180 2 и 137 1 соответственно. [45]
Страницы: 1 2 3 4