Раствор - кипята
Cтраница 1
Растворы кипят при более высокой температуре, чем чистая вода, и температура кипения растворов повышается с увеличением их концентрации. Таким образом, по мере выпаривания растворов их температура будет повышаться и разность температур между теплоносителем и выпариваемым раствором будет уменьшаться, что означает ухудшение условий передачи тепла. Кроме того, будет уменьшаться и значение коэфициента теплопередачи, так как раствор по мере выпаривания будет становиться все более вязким и труднотекучим, а на стенках, обращенных к раствору, может начаться отложение осадков солей. Следовательно, тепловой режим выпаривания по мере течения процесса будет непрерывно изменяться. [1]
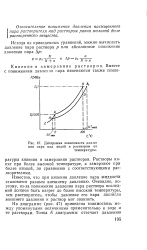 |
Диаграмма зависимости давления пара над водой и раствором от. [2] |
Растворы кипят при более высокой температуре, а замерзают при более низкой, по сравнению с соответствующими растворителями. [3]
Все растворы кипят при более высокой, а замерзают при более низкой температуре, чем чистый растворитель. Это связано с понижением упругости пара над раствором в сравнении с упругостью пира над чистым растворителем. Кипение жидкости наступает тогда, когда упругость ее паров, насыщающих пространство, будет равна внешнему давлению. Замерзание жидкости наступает, когда упругость пара над твердым веществом и над жидкостью будет одинакова. [4]
Объясните, почему растворы кипят при более высокой, а замерзают при более низкой температуре, чем чистый растворитель. [5]
Температуру кипения разбавленных растворов солей можно приближенно определить, принимая, что разность температур кипения разбавленного раствора и воды остается при любом разрежении такой же, как и при атмосферном давлении, причем растворы кипят при более высокой температуре, чем чистая вода. [6]
Температуру кипения разбавленных растворов солей можно определить приближенно, принимая, что разность между температурами кипения разбавленного раствора и воды остается при любом разрежении такой же, как и при атмосферном давлении, причем растворы кипят при более высокой температуре, чем чистая вода. [7]
Температуру кипения разбавленных растворов солей можно определить приближенно, принимая, что разность между температурами кипения разбавленного раствора и воды остается при любом разрежении такой же, как и при атмосферном дав лени и, причем растворы кипят при более высокой температуре, чем чистая вода. [8]
Наиболее распространенными среди них являются методы определения по повышению температуры кипения я по понижению температуры замерзания. Известно, что растворы кипят при более высокой температуре, чем чистый растворитель, причем повышение температуры кипения прямо пропорционально концентрации раствора. [9]
Если к кипящему строго нейтраль - - ному раствору хлоридов родия прибавить кипящий раствор йодистого калия, то выпадает довольно скоро почти черный осадок йодистого родия. Для полного выделения родия смесь растворов кипят 4 - 5 мин. В случае присутствия иридия процесс осаждения повторяют. Для этого полученный при первом осаждении йодистый родий растворяют в царской водке, раствор выпаривают досуха и повторяют осаждение йодистым калием. [10]
Изотерма растворимости при 125 ( рис. 6) отличается тем, что на ней отсутствует кривая растворимости соли TiOS04 H2S04 2H20 вследствие неустойчивости ее при этой температуре. Кроме того, при атмосферном давлении не реализуются разбавленные растворы, в которых сульфаты титана гид-ролизуются до двуокиси, так как эти растворы кипят при более низкой температуре. [11]
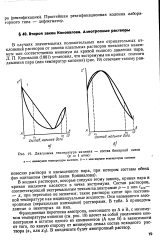 |
Диаграмма температура кипения - состав бинарной смеси. [12] |
В жидких растворах, которые следуют этому закону, кривая пара и кривая жидкости касаются в точке экстремума. Состав растворов, соответствующий экстремальным точкам на диаграмме р - х или гкип - - оХ, при перегонке не меняется; такие растворы кипят при постоянной температуре как индивидуальные жидкости. Они называются азео-тропными ( нераздельно кипящими) растворами. В табл. 5 приведены данные о некоторых из них. [13]
На свойства разбавленных растворов влияют в основном два фактора: природа растворителя и растворенного вещества и концентрация. Исходя из этого, растворы обладают следующими характерными свойствами: 1) давление пара раствора ниже давления пара растворителя; 2) растворы замерзают при более низкой температуре, чем их растворители; 3) растворы кипят при более высокой температуре, чем их растворители. [14]
На многих установках среднего размера ( например, травильные установки в сталелитейной промышленности), не производящих пар, в качестве охлаждающей жидкости используются кислоты или другие разбавленные растворы. В таких вакуум-кристаллизационных установках вода кипит в испарителе при 0 С, и образующийся пар конденсируется в конденсаторе смешения кислотой или охлаждающим раствором. Процесс возможен, если кислота или раствор кипят при более низком давлении, чем вода. [15]
Страницы: 1 2