Раствор - азотная кислота
Cтраница 1
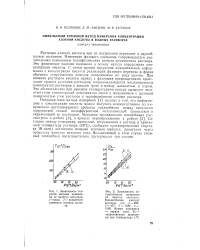
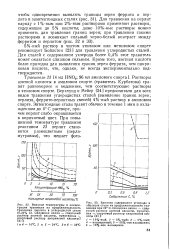
Раствор азотной кислоты в уксусной кислоте - мягкий нитрующий агент, используется для нитрования по-лиалкилбензолов и гетероциклов. [1]
Раствор азотной кислоты и промывные воды из поглотительного сосуда сливают в делительную воронку и нейтрализуют 10 % - ным раствором аммиака по лакмусу. К полученному нейтральному раствору прибавляют 15 мл раствора для экстрагирования свинца, а затем из бюретки по 1 мл раствора дитизона, каждый раз встряхивая содержимое делительной воронки 15 - 30 сек. Дитизон прибавляют до тех пор, пока не будет заметен его избыток. Хлороформный слой сливают в другую делительную воронку, прибавляют 20 мл раствора для экстрагирования дитизона и взбалтывают. При этом избыток дитизона переходит в водную фазу. Экстрагирование повторяют до тех пор, пока прибавленный водный раствор не будет практически бесцветным. [2]
Раствор азотной кислоты в серной является столь энергичным нитрующим агентом, что изучать кинотику нитрования этим реагентом можно только применяя ароматические соединения низкой активности. [3]
Раствор азотной кислоты в безводной серной кислоте обладает высокой электропроводностью. [4]
Раствор азотной кислоты, оставшийся от предыдущей партии, укрепляется концентрированной азотной кислотой. Перед загрузкой в ацетилятор раствор подогревается до требуемой температуры путем циркуляции его через специальный теплообменник. [5]
Раствор азотной кислоты оказывает только осветляющее воздействие. [6]
Раствор азотной кислоты в эфире редко применяется для нитрования. Впрочем, в литературе описано несколько случаев нитрования по этому способу. [7]
Раствор азотной кислоты с концентрацией ниже 23 % практически не очищает ацетилен, так как в этих условиях выделяется черный осадок металлического серебра. [8]
Растворы азотной кислоты при их нагревании переходят в парообразное состояние. Изменение фазового состояния сопровождается значительным изменением теплофизических свойств компонентов раствора. Это физическое явление положено в основу метода определения концентрации кислоты. С точки зрения получения измерительной информации о концентрации кислоты реализация фазового перехода в форме О бычиого непрерывного кипения неприемлемо по ряду причин. При кипении растворов кислоты наряду с фазовыми превращениями происходит процесс разгонки растворов, сопровождающийся массопереносом компонентов растворов в жидкой фазе и между жидкостью и паром. Это обстоятельство при высоком температурном напоре вызывает несоответствие концентраций компонентов смеси в пограничном с греющей поверхностью слое раствора и периферийными слоями раствора. [10]
Растворы азотной кислоты и гидроксида натрия объемом 1 л каждый содержат соответственно HNO3 массой 18 9 г и NaOH массой 3 2 г. Какова молярная концентрация этих растворов и в каком объемном отношении они должны быть смешаны для получения нейтрального раствора. [11]
Растворы азотной кислоты чрезвычайно агрессивны и вызывают повреждения кожи, глаз и слизистых оболочек, серьезность которых зависит от длительности контакта с кислотой и ее концентрации - от раздражения и ожогов до местного некроза в случае длительного контакта. Пары азотной кислоты также вызывают повреждение кожи, слизистых оболочек и зубной эмали. [12]
Растворы азотной кислоты готовили путем разбавления концентрированной кислоты, концентрацию определяли титриметрически относительно трис ( гидроксиметил) аминометана. [13]
Растворы азотной кислоты в амиловом спирте ( травитель Курбатова) травят равномернее и медленнее, чем соответствующие растворы в этиловом спирте. [15]
Страницы: 1 2 3 4