Раствор - окрашенный комплекс
Cтраница 2
При добавлении этих реагентов к водным растворам солей двухвалентного кобальта образуются окрашенные в красный цвет растворимые соединения, в которых кобальт трехвалентен. Комплексы после своего образования не разрушаются сильными кислотами и их окраска устойчива при подкислении. Максимумы светопоглощения растворов окрашенных комплексов находятся при 420 и 520 ммк. [16]
Соединение циркония, в отличие от соединений других металлов, устойчиво при относительно высокой кислотности раствора. Из всех антрахино-нов наиболее пригоден ализаринсульфонат ( ализарин S), который в этанольной среде образует с цирконием устойчивый коллоидный раствор. Оптическая плотность, растворов окрашенного комплекса пропорциональна концентрации циркония до 4 мкг в 1 мл. Ализариновое соединение циркония имеет наименьшую величину частиц по сравнению с соединениями других антрахинонов. При стоянии происходит коагуляция. Конечная кислотность раствора сильно влияет на интенсивность окраски. Гюбели и Якоби [482] предлага - - ют определять цирконий в 0 2 N солянокислой или хлорнокислой среде. Однако авторы считают результаты плохо воспроизводимыми из за полимеризации циркония. При рН 3 - 1 в солянокислой среде присутствуют трехатомные ионы циркония. При более высокой кислотности наблюдается деполимеризация. V соляной кислоте вызывает деполимеризацию и увеличение скорости реакции. Фториды, сульфаты, фосфаты, вольфраматы и органические оксикислоты ослабляют или уничтожают окраску соединения ализарина S с цирконием вследствие образования очень устойчивых комплексов. Железо не мешает, если оно восстановлено до двухвалентного. Для устранения влияния ряда элементов при определении циркония Полуэктов [230] предложил применять комплексен III, который в определенных условиях связывает цирконий в растворимый бесцветный комплекс, не изменяя окраски соединений других металлов. Поэтому раствором для сравнения при фотометрическом определении циркония служит тот же раствор, но с добавкой комплексона III. При высоком содержании мешающих элементов цирконий предварительно выделяют фениларсоновой кислотой из 1 W солянокислого раствора. [17]
Основная причина низкой селективности молекулярной спектрофотометрии обусловлена самой природой молекулярных спектров поглощения. Последние представляют собой широкие полосы, занимающие участки спектра, протяженностью до десятков и сотен миллимикрон. При наличии в растворе окрашенных комплексов нескольких элементов полосы перекрывают друг друга, что создает необходимость устранения из раствора мешающих элементов. [18]
Большой интерес с точки зрения анализа примесных газов ( в том числе газовых загрязнений атмосферы) представляют фотоколориметрические ( ФК) газоанализаторы. В основе их работы лежит цветная избирательная реакция химического взаимодействия между определяемым компонентом и индикаторным раствором. Она характеризуется образованием в растворе цветных окрашенных комплексов, изменяющих его оптическую плотность. Концентрация этих комплексов, а следовательно, и количество прореагировавшего газа, определяют методом светопоглощения. [19]
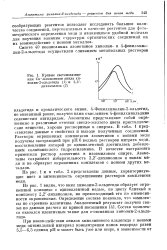 |
Кривые светопоглоще. [20] |
Фенилхинолин-2 - альдегид, не описанный ранее, получен нами окислением 4-фенилхинальдина селенистым ангидридом. Азометины представляют собой окрашенные в различные оттенки светло-желтого цвета кристаллические вещества, хорошо растворимые в спиртах. В табл. 1 представлены данные о свойствах и выходе полученных соединений. Растворы окрашенных комплексов азометинов с ионами меди получены экстракцией при рН 6 водных растворов нитрата меди, восстановление которой до одновалентной достигалось добавлением солянокислого гидроксиламина. [21]
При установке титра с помощью оксалата требуется также раствор соли Мора, который готовят описанным ниже способом. Нормальность этого раствора должна быть такой же, как нормальность раствора сульфата церия или немного больше. Для установки титра тщательно отмеряют две порции раствора, содержащего сульфат церия, объемом по 10 мл и помещают их в колбы для титрования объемом приблизительно по 50 мл. Перед достижением конечной точки титрования добавляют каплю 0 025 М раствора окрашенного комплекса железа ( II) с о-фенантролином. [22]
При установке титра с помощью оксалата требуется также раствор соли Мора, который готовят описанным ниже способом. Нормальность этого раствора должна быть такой же, как нормальность раствора сульфата церия или немного больше. Для установки титра тщательно отмеряют две порции раствора, содержащего сульфат церия, объемом по 10 мл и помещают их в колбы для титрования объемом приблизительно по 50 мл. Перед достижением конечной точки титрования добавляют каплю 0 025 М раствора окрашенного комплекса железа ( II) с о-фенантролином. К другой пррции раствора сульфата церия добавляют тщательно отмеренный раствор оксалата натрия, объем которого немного меньше объема раствора сульфата церия. Растворы перемешивают и нагревают в течение 5 мин. Избыток сульфата церия оттитровы-вают раствором соли Мора, как это описано выше, используя в качестве индикатора каплю раствора окрашенного комплекса железа ( II) с о-фенантролином. [23]
Страницы: 1 2