Раствор - манганат
Cтраница 3
Демонстрационный бокал, стакан емкостью 1 л, стеклянная палочка, источник углекислого газа; раствор манганата калия. [31]
Почему зеленый раствор манганата калия на воздухе постепенно изменяет свою окраску до малиновой, а при добавлении кислоты к раствору манганата окраска раствора изменяется более интенсивно. В какую сторону смещается химическое равновесие. [32]
Электрическая схема установки приведена в приложении I. Во время электролиза контролируют содержание в растворе манганата и перманганата. С этой целью через каждые 20 - 30 мин на некоторое время отключают ток, отбирают для анализа пробу электролита и определяют привес катода кулонометра. [33]
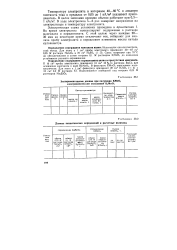 |
Данные аналитических определений и расчетные величины. [34] |
Электрическая схема установки приведена в приложении I. Во время электролиза контролируют содержание в растворе манганата и перманганата. С этой целью через каждые 20 - 30 мин на некоторое время отключают ток, отбирают для анализа пробу электролита и определяют изменение массы катода кулонометра. [35]
При окислении ртути раствором манганата ( VII) калия образуются оксид марганца ( IV) МпСЬ, гидроксид калия и оксид ртути. Для окисления 0 600 г ртути требуется 50 0 см3 раствора манганата ( VII) калия концентрации 0 0200 моль-дм-3. [36]
В табл. I представлены экспериментальные данные, полученные при изучении процесса электролиза растворов манганата калия в бездиафрагменней ячейке. [37]
Описывается автоклавный метод производства манганата кадия, внедренный на химическом заводе. Приводятся сравнительные данные для печного и автоклавного методов получения манганата калия и электролиза растворов манганата калия в бездиафратенных электролизерах и электролизерах с диафрагмой в виде катодного чехла из щело-честойкой ткани, пропитанной лаком ХСЛ. [38]
Многие из этих соединений совершенно стабильны в нейтральном или щелочном растворе, однако результат подкисления таких растворов в различных случаях очень различен. Гипотетические кислоты Н2МпО4 и H2FeO4 не могут быть получены даже в растворе, так как подкис-ление растворов манганатов и ферратов приводит только к осаждению окисла переходного металла. Кислоты Н0СгО4 и НМпО4 могут быть получены в концентрированном растворе, но в безводном состоянии не были выделены. Mo, W и U, кислородные соединения которых будут рассмотрены ниже. Элементы ванадий, ниобий, тантал, молибден, вольфрам и уран замечательны тем, что образуют много комплексных солей при сплавлении высших окислов этих соединений со щелочами. [39]
Образуется раствор манганата калия зеленого цвета. [40]
Химическое окисление, основанное на взаимодействии манганата калия с хлором или двуокисью углерода, позволяет получать перманганат с невысоким выходом. Значительно лучшие результаты дает электрохимическое окисление; протекающее при электролизе раствора манганата с нерастворимым анодом. [41]
В фарфоровой чашке нагревают до 65 С 40 мл дистиллированной воды и растворяют в ней 10 г перманганата калия. Добавляют 60 г 50 % - кого раствора едкого кали и кипятят до прекращения выделения кислорода. Раствор сливают в стакан и охлаждают его в чашке со льдом: выпадают кристаллы черно-зеленого цвета. С кристаллов осторожно сливают избыток раствора и переносят их на пористую пластинку, которую помещают в эксикатор над серной кислотой. Сухие кристаллы высыпают в банку с притертой пробкой, из которой воздух вытеснен азотом. Для работы готовят 1 % - ный раствор манганата калия. [42]
Страницы: 1 2 3