Раствор - перхлорат
Cтраница 1
Раствор перхлората, сульфата или нитрата тория, содержащий от 2 до 50 мг Th и не более 6 мл QN минеральной кислоты, упаривают до 50 мл. Добавляют 40 мл концентрированной НМОз и предварительно отфильтрованный раствор 14 г метапериодата натрия в 100 мл воды. Раствор разбавляют до 230 мл и охлаждают до комнатной температуры. Добавляют 2 мл перегнанного ( 3-оксиэтилацетата при механическом перемешивании Если в исследуемом растворе присутствует 50 - 100 мг Th, осаждение начинается примерно через 10 мин. [1]
 |
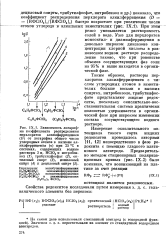
Влияние насыщающего раствор газа на выход реакции восстановления перхлората церия ( IV. О - водород. д-воздух. х - кислород. П - азот. [2] |
Растворы перхлората церия ( IV) готовились из химически чистых нитрата церия ( III) и хлорной кислоты. [3]
Раствор перхлората таллия может быть приготовлен химическим способом - растворением углекислого таллия или гидрата окиси таллия в хлорной кислоте. [4]
Плотность растворов перхлората аммония в воде24 и в водной хлорной кислоте25 была определена при 15 и 25 С. Данные по электропроводности растворов перхлората аммония в безводной синильной кислоте26 и нитрометане27 показывают, что к этим растворам применимо уравнение Дебая-Хкжеля - Онзагера. [5]
Для приготовления раствора перхлората циркония навеску хлорокиси циркония около 0 36 г растворяют в фарфоровой чашке при нагревании в рассчитанном количестве хлорной кислоты и упаривают раствор до удаления паров соляной кислоты. [6]
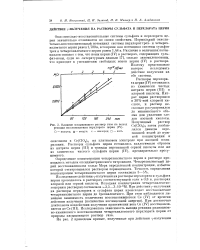
 |
Спектры поглощения. / - спаднс по отношению к воде. 2 - соединение циркония со. [7] |
Для приготовления раствора перхлората циркония навеску хлорокиси циркония 0 36 г растворяют в фарфоровой чашке при нагревании в рассчитанном количестве хлорной кислоты и упаривают раствор до удаления паров соляной кислоты. [8]
При пропускании раствора перхлората калия через ка-тионит в Н - форме ионы К обмениваются на ионы Н, которые затем оттитровывают раствором щелочи. [9]
Быстро титруют раствором перхлората бария в присутствии индикатора торона ( 3 капли) до перехода желтой окраски в розовую. [10]
Таким образом, растворы перхлоратов алкилферрицениев с числом углеродных атомов в заместителях больше восьми в высших спиртах, нитробензоле, трибутилфос-фате представляют жидкие редок-ситы, поскольку окислительно-восстановительная система практически полностью удерживается в органической фазе при широком изменении состава сосуществующего водного раствора. [12]
При введении в раствор перхлората лития LiClO4 ( соли с необщим ионом) происходит увеличение как скорости сольволиза, так и скорости рацемизации. При достаточно большой концентрации ЫС1О4 кривые нормального солевого эффекта для сольволиза и рацемизации почти параллельны. [14]
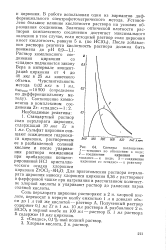
 |
Влияние концентрации LiClO4 на ско - от концентрации LiClO4 неожиданно рость ацетолиза ( - трео-3 - анизилбутил-2 - бро. [15] |
Страницы: 1 2 3 4