Раствор - перхлорат
Cтраница 2
При введении в раствор перхлората лития LiQC4 ( соли с необщим ионом) происходит увеличение как скорости сольволиза, так и скорости рацемизации. При достаточно большой концентр ации LiClC4 кривые нормального солевого эффекта для сольволиза и рацемизации почти параллельны. [16]
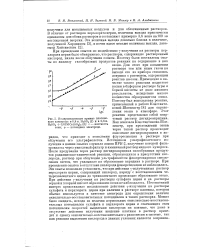 |
Поляризационные кривые платинового электрода вО 8н. H2S04 ( J и в 0 8н. H2S04 0 01М Се ( 804Ь ( 2. i - плотность тока. ф - потенциал электрода. [17] |
В отличие от растворов перхлората церия, величины выхода практически одинаковы для обоих растворов и составляют примерно 3 6 иона на 100 эв поглощенной энергии. [18]
При изучении окисления растворов перхлората двухвалентного хрома молекулярным кислородом Ардон и Стейн [128] пришли к выводу об образовании вначале комплексов трехвалентного хрома с кислородным мостиком. [19]
Данные об электропроводности растворов перхлоратов щелочных металлов в ацетонитриле соответствуют ожидаемому увеличению сольватации: Cs Rb К Na Li. Значения асСоц изменяются в обратном порядке. Из данных для тетраметиламмониевых солей видно, что анионы I и NOs ведут себя в CH3CN одинаково. [20]
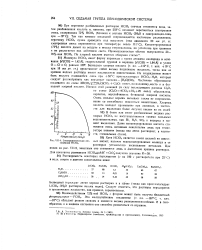 |
Электролитическая те - ных кислот, наличие недиссоциированных молекул в ее. [21] |
Следует отметить, что растворы перхлоратов в органических жидкостях, как правило, взрывоопасны. [22]
При добавлении NaOH к растворам перхлоратов, хлоридов и нитратов циркония и гафния Осадки начинают образовываться при введении 0 80 - 0 90 г-экв щелочи на 1 г-атом циркония и гафния. [23]
Титруют 0 01 М раствором перхлората бария при лампе дневного света и вблизи конечной точки добавляют по 0 2 мкл, пока окраска не совпадет с окраской раствора сравнения. К концу титрования осторожно вращают колбу, чтобы собрать следы сульфата, которые могли остаться на стенках. [24]
Элемент перед употреблением заливают раствором перхлората магния. [25]
В первом приближении 0 Ш растворы перхлората и сульфата цинка ( II) должны иметь одинаковое значение рН при 25 С ( почему. [26]
Авторы заметили, что электропроводность растворов перхлората и хлорида тетраэтиламмо-ния, а также хлоридов лития и калия в хлорангидридах бензойной и фенилфосфорной кислот круто возрастает в присутствии воды. Это явление легко объясняется гидролизом растворителя с образованием эквивалентного количества хлористого водорода, который и увеличивает электропроводность системы. Этот вывод подтверждается тем, что введение в раствор хлористого водорода дает аналогичный эффект. [27]
Низкая селективность наблюдается при разделении растворов перхлоратов, цианидов, тиоцианидов и растворенных в воде газов, а также слабодиссоциированных органических соединений с малой молекулярной массой. Селективность разделения органических соединений возрастает с увеличением их молекулярного веса и особенно при разветвленной структуре молекул. С высокой селективностью протекает мембранное разделение растворов полимеров и коллоидов. [28]
Перхлоратный свинцовоталлиевый электролит получают смешением растворов перхлората таллия и свинца. [29]
Помимр перечисленных химических способов приготовления раствора перхлората таллия, успешно может быть применен [59] электрохимический метод, основанный на анодном растворении таллия в растворе хлорной кислоты, содержащей 10 Г / л пептона. [30]
Страницы: 1 2 3 4