Раствор - полиэлектролит
Cтраница 3
Таким образом, свойства раствора полиэлектролита, как и любого другого раствора полимера, определяются двумя взаимосвязанными факторами: конформационным состоянием полимерной цепи и взаимодействием ее с растворителем. [31]
Рассмотрим зависимость осмотического давления растворов полиэлектролитов от рН и присутствия электролитов так, как ее представлял себе Доннан, а затем уже объясним, исходя из этой концепции, влияние рН и низкомолекулярных электролитов на объем набухшего студня и вязкость растворов полимеров. [32]
В отличие от поведения растворов гибких полиэлектролитов при изменении ионной силы в 104 раз точки группируются около одной кривой, указывая на неизменность в этих условиях размеров молекул ДНК и иллюстрируя этим их значительную жесткость. [33]
Для изучения коллигативных свойств растворов полиэлектролитов Лифсон и Качальский [24] предложили ячеечную модель полиэлектролитов. [34]
Рассмотрим ионизационное равновесие в растворе полиэлектролита, например, слабой поликислоты, содержащей Р ионоген-ных групп в макромолекуле. Если в каждом мономерном звене присутствует одна ионогенная группа, то Р совпадает со степенью полимеризации. Степень диссоциации такого полиэлектролита, вообще говоря, определяется различными константами диссоциации. [35]
Наличие заряда на полиионах сообщает растворам полиэлектролитов ряд особых гидродинамических, электрических, оптических и других свойств. [36]
Вклад в перенос электричества в растворах полиэлектролитов вносят как противоионы, так и полиион. Интересной особенностью полиэлектролитов является то, что при условиях, когда их можно считать свободно проницаемыми для растворителя клубками, их электропроводность не зависит от молекулярной массы. [37]
Из рисунка видно, что для растворов полиэлектролитов в дистиллированной воде зависимость приведенной вязкости от концентрации имеет нелинейный характер с явно выраженным минимумом. Экстраполяция левой ветви этой кривой до нулевой концентрации, как это предлагается некоторыми авторами, неизбежно приведет к значительным ошибкам, так как при этом не учитывается наличие максимума в области очень низких концентраций. [38]
Это вызвано тем, что для растворов полиэлектролитов к факторам, влияющим на размеры клубка и его плотность, добавляется еще один фактор: степень диссоциации. В диссоциированном состоянии одинаково заряженные группы макромолекул отталкиваются, что приводит к увеличению размеров клубка, а это, в свою очередь, значительно увеличивает вязкость. Вязкость водных растворов полиэлектролитов, например полиакриловой кислоты ( см. опыт 3 - 10), определяется конкуренцией двух процессов. [39]
Известно, что при добавлении к растворам полиэлектролитов многозарядных катионов может наблюдаться агрегация макроионов с образованием нерастворимой фазы. [40]
Раствор электролита приводят в контакт с раствором полиэлектролита ( пептиновая кислота, карбоксицеллюлоза, карбоксиметилцеллюлоза, полиглюкозамин, поли-этиленамин и др.), при этом противоион в растворе электролита медленно диффундирует в полиэлектролит, понижая плотность его заряда. В результате происходит дегидратация полиэлектролита с образованием геля. [41]
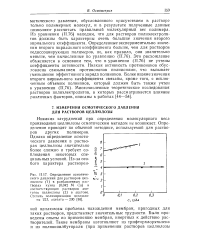
Однако реально измеренное осмотическое давление в растворе полиэлектролита я всегда отличается от яид; обычно я меньше, чем яид. Поэтому используют уравнение Вант-Гоф - фа, введя в него практический осмотический коэффициент Ф, учитывающий все отклонения от идеальности, связанные с про-тивоионами. Величина Фя / лид служит одной из самых основных характеристик полиэлектролитов. [42]
Однако реально измеренное осмотическое давление в растворе полиэлектролита я всегда отличается от яид; обычно я меньше, чем яид. Поэтому используют уравнение Вант-Гоффа, введя в него практический осмотический коэффициент Ф, учитывающий все отклонения от идеальности, связанные с противо-ионами. Величина Ф я / яид служит одной из самых основных характеристик полиэлектролитов. [43]
Если такая мембрана разделяет коллоидную систему или раствор полиэлектролита и чистую дисперсионную среду, то часть ионов переходит через мембрану в дисперсионную среду и устанавливается так называемое доннановское равновесие. Многократно заменяя дисперсионную среду за мембраной, можно очистить дисперсную систему от примесей электролитов. Этот метод очистки дисперсных систем и растворов высокомолекулярных веществ от электролитов назван диализом. [44]
Страницы: 1 2 3 4