Раствор - соль - трехвалентное железо
Cтраница 2
Для переведения FeT в Fe к раствору соли трехвалентного железа приливают избыток раствора соли двухвалентного хрома. Затем раствор взбалтывают в течение 3 - 5 мин. После окисления двухвалентного хрома двухвалентное железо титруют тем или другим окислителем. [16]
Для переведения Fe3 в Fe2 к раствору соли трехвалентного железа приливают избыток раствора-соли двухвалентного хрома. Затем раствор взбалтывают в течение 3 - 5мин или оставляют стоять 10 - 15 мин; при этом двухвалентный хром полностью окисляется кислородом воздуха, в то время как двухвалентное железо в сильнокислом растворе по отношению к кислороду достаточно устойчиво. После окисления двухвалентного хрома двухвалентное железо титруют тем или другим окислителем. [17]
Тидратированный ион Fe34 почти бесцветен, но растворы солей трехвалентного железа Обычно имеют бурую окраску из-за наличия гидроксосоединений, образующихся при гидролизе. [18]
На каждые 100 мл разбавленного соответствующим образом раствора соли трехвалентного железа прибавляют 1 мл 50 % - ного раствора ацетата аммония и титруют потенциометрически 0 1 М раствором комплексона. Результат определения не зависит от объема титруемого раствора. [19]
В сосуд для титрования помещают 20 мл раствора соли трехвалентного железа, пропускают 5 - 10 мин. Со всеми изученными индикаторами, получены практически совпадающие результаты. [20]
Это титрование производится в присутствии индикатора - раствора соли трехвалентного железа. [21]
 |
Схема гальванического элемента. /, 2-ячейки. 3, 4 - электроды. [22] |
Если, например, налить в ячейку 1 раствор соли трехвалентного железа, а в ячейку 2 - двухвалентного олова, то в цепи возникает ток, так как электроны восстановителя свободно передвигаются через металлический проводник к ионам окислителя. Соударение ионов окислителя с ионами восстановителя заменяется при этом соударением каждого из этих ионов с соответствующим электродом. [23]
Для получения гидроксида железа ( III) к раствору соли трехвалентного железа, например нитрату или хлориду, подогретому до 50 - 60 С, приливают водный раствор аммиака в избытке. Выпавший гидроксид железа ( III) несколько раз промывают декантацией ( горячей водой), затем отфильтровывают и осадок промывают па фильтре до полного удаления нитрат-ионов или хлорид-ионов. [24]
Необходимо, однако, иметь в виду, что растворы солей трехвалентного железа в нейтральной среде гидролизуются и сами вызывают изменение цвета жидкости. Во избежание этого раствор индикатора приготовляют таким путем. Нагревая, приготовляют насыщенный раствор железо-аммиачных квасцов, дают раствору охладиться и затем фильтруют. К профильтрованной жидкости прибавляют концентрированную азотную кислоту до тех пор, пока она не сделается почти бесцветной. Это происходит вследствие того, что при прибавлении кислоты увеличивается концентрация ионов Н и тем задерживается гидролиз квасцов. Приготовленный таким путем индикатор прибавляют в количестве 2 - 3 мл к исследуемому раствору. [25]
Необходимо, однако, иметь в виду, что растворы солей трехвалентного железа в нейтральной среде легко гидролитически распадаются и сами вызывают изменение цвета жидкости, что мешает определить конец реакции. Во избежание этого раствор индикатора приготовляют обычно таким путем. При нагревании приготовляют насыщенный раствор железо-аммонийных квасцов, дают раствору охладиться и затем фильтруют. [26]
Феррицианид калия Кз [ Ре ( СМ6 ] окрашивает раствор соли трехвалентного железа в бурый цвет. [27]
Необходимо, однако, иметь в виду, что растворы солей трехвалентного железа в нейтральной среде гидролизуются и сами вызывают изменение цвета жидкости. Во избежание этого раствор индикатора приготовляют таким путем. Нагревая, приготовляют насыщенный раствор железо-аммиачных квасцов, дают раствору охладиться и затем фильтруют. К профильтрованной жидкости прибавляют концентрированную азотную кислоту до тех пор, пока она не сделается почти бесцветной. Это происходит вследствие того, что при прибавлении кислоты увеличивается концентрация ионов Н и тем задерживается гидролиз квасцов. Приготовленный таким путем индикатор прибавляют в количестве 2 - 3 мл к исследуемому раствору. [28]
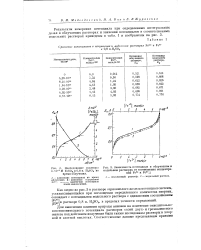 |
Исследование раствора.| Зависимость потенциала в облученном и модельном растворах от соотношения концентраций Fe3 и Fea. j 1 - облученный раствор. 2 - - модельный раствор. [29] |
Для выяснения влияния природы анионов на изменение окислительно-восстановительного потенциала растворов солей двух-и трехвалентного железа под действием излучения были также исследованы растворы в хлорной и азотной кислотах. [30]
Страницы: 1 2 3 4