Раствор - соль - металл
Cтраница 1
Растворы солей металлов более электроположительных, чем железо, должны применяться сильно разбавленными, чтобы только следы этих металлов осаждались на подлежащих фссфатированию поверхностях, образуя центры кристаллизации фосфатов. [1]
Растворы солей металлов, необходимые для исследования, были изготовлены из химически чистых хлоридов с концентрацией примерно 1 мг / мл ( в расчете на окись); титр растворов был установлен весовым путем. Реактивом для осаждения служил раствор коричнокислого аммония, 5 % - ный по коричной кислоте. [2]
 |
Влияние паров растворителей на индикаторный порошок. [3] |
Растворы солей металлов V и VI группы периодической системы в концентрированной серной кислоте окрашиваются в присутствии паров бензола и его гомологов. [4]
Растворы солей металлов переменной валентности, изоциана-тов и аминов в инертных растворителях могут применяться как модификаторы склеиваемых поверхностей. [5]
Если раствор соли металла добавить к раствору поликремневой кислоты, то соединение получается в том случае, если рН будет выше критической величины, которая значительно зависит от металла. Например, Хейзел, Шок и Гордон [63] нашли, что при значениях рН, лежащих в интервале от 2 до 3, ион железа с кремневой кислотой, приготовленной катионным обменом, реагирует сильно, алюминий и хром слабее, барий, лантан и медь при таком рН не реагируют. [6]
В растворах солей металлов менее электроотрицательных, чем водород, на катоде может выделяться уже металл. [7]
В растворах солей металлов, подкисленных слабыми кислотами, а также в растворах комплексных соединений простым погружением, как правило, покрытие получить не удается. [8]
В растворах солей металлов, менее электроотрицательных, чем водород, на катоде может выделяться уже металл. При электролизе кислот ( не содержащих кислорода) и их солей на аноде, как правило, разряжаются соответствующие анионы. [9]
При добавлении раствора соли металла к раствору поликремневой кислоты, рН которого выше некоторого критического значения, зависящего в значительной степени от самого металла, происходит о бразование соединения. [10]
При приготовлении растворов солей металлов обычно не имеет значения, какой анион присутствует в растворе употребляемой соли. Однако для некоторых определений характер аниона важен; в этих случаях следует подбирать соответствующую соль или растворять металл в соответствующей кислоте. [11]
При распылении раствора соли металла в пламя растворитель испаряется. Дальнейшее испарение и распад соли приводят к образованию в пламени атомов или простых молекул. [12]
При приливании раствора соли металла к сложному пептизатору эффективность последнего как комплексообразователя ослабевает, и по мере прибавления соли металла устойчивость комплекса уменьшается. Такой путь образования комплекса приемлем для изучения устойчивости его в зависимости от изменения состава сложного пептизатора и для аналитических целей. [13]
По второму способу раствор соли металла сильно разбавляют, значение рН его доводят доЗ - 4, а затем, как и в первом случае, подают на колонку, заполненную монофункциональной иминодиуксусной смолой. В остальном элюирование происходит так, как описано в первом способе. [14]
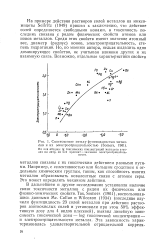 |
Соотношение между фунгицидностью металлов и их электроотрицателыюстью ( Somers, 1961. [15] |
Страницы: 1 2 3 4