Раствор - соль - данный металл
Cтраница 2
Гравитационные цепи состоят обычно из двух жидких электродов разной высоты, изготовленных из одного и того же металла. Электроды погружены в раствор соли данного металла. [16]
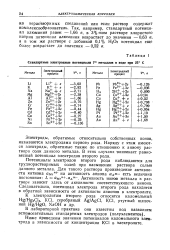 |
Стандартные электродные потенциалы Vго металлов в воде при 25 С. [17] |
Электроды, обратимые относительно собственных ионов, называются электродами первого рода. Наряду с этим имеются электроды, обратимые также по отношению к аниону раствора соли данного металла. В этих случаях возникает равновесный потенциал электродов второго рода. [18]
Одним из условий использования изотопных индикаторов для количественного определения скорости истинного электродного процесса, например скорости ионизации металла, является равномерное распределение радиоактивных и нерадиоактивных частиц металла в обеих фазах. При соблюдении этого условия, которое легко осуществимо в случае системы, состоящей из амальгамы и раствора соли данного металла, скорость ионизации ( Ме - Меп пе) может быть найдена следующим образом. [19]
Во многих существующих металлургических процессах имеются проблемы, которые могут быть с экономической выгодой разрешены путем применения ионообменных процессов. Например, металлы, содержащиеся в растворах от выщелачивания, могут быть сконцентрированы на ионообменных смолах, отделены от примесей и затем элюированы из смолы в виде растворов солей данных металлов. Соли металлов затем подвергаются дальнейшей переработке путем электролиза, осаждения, восстановления или выпаривания. [20]
Электролиз используют для получения чистых металлов. Для этого очищаемый металл отливают в виде пластин и делают их анодами в электролитической ванне. Электролитом служит раствор соли данного металла. [21]
 |
Схема гальванического элемента. [22] |
В результате взаимодействия между электродом ( пластинкой) и раствором электрод приобретает электрический заряд. Разность потенциалов, возникающая на границе металл - раствор электролита, называют электродным потенциалом; его величина и знак ( - f - или -) зависят от природы металла и раствора, в котором он находится. При внесении пластинки металла в воду или раствор соли данного металла в воде его ионы отрываются от поверхностного слоя в результате взаимодействия с сильно полярными молекулами воды; переходят в воду или раствор и гидратируются. [23]
 |
Двойной электрический слой. [24] |
Система, состоящая из металла, погруженного в раствор его ионов, называется электродом. Разность потенциалов на границе между металлом и раствором называют электродным потенциалом. Выше было указано, что заряд металлической пластинки, погруженной в раствор соли данного металла, зависит от концентрации соли. [25]
Процесс происходит в электролитической ванне. Анодом служит металл, подлежащий очистке, катодом - тонкая пластинка из чистого металла, а электролитом - раствор соли данного металла, например при рафинировании меди - раствор медного купороса. [26]
Процесс происходит в электролитической ванне. Анодом служит металл, подлежащий очистке, катодом - тонкая пластинка из чистого металла, а электролитом - раствор соли данного металла, например при рафинировании меди - раствор медного купороса. В загрязненных металлах могут содержаться ценные примеси. Например, в меди часто содержатся никель и серебро. Для того чтобы на катоде выделялся только чистый металл, необходимо учитывать, что выделение каждого вещества начинается лишь при некоторой определенной разности потенциалов между электродами, называемой потенциалом разложения. При надлежащем ее выборе из раствора медного купороса на катоде выделяется чистая медь, а примеси выпадают в виде осадка или переходят в раствор. [27]
У электрода должен, следовательно, существовать определенный скачок потенциала. Скачок потенциала, однако, ни в коем случае не должен быть ( да почти никогда и не бывает) равным тому, который показывает соответственный массивный металл, опущенный в раствор, так как осажденный на электроде металл или же его твердый раствор в данном электроде не обладает концентрацией массивного металла. Это воззрение кажется на первый взгляд странным, так как мы привыкли считать концентрацию металла неизменной; последнее справедливо однако лишь до определенного предела. Если слой металла не достиг, по крайней мере, толщины в одну молекулу, то он не действует более как массивный металл. При осаждении соответствующих металлов из растворов их солей на платиновых пластинках последние в растворе соли данного металла показывали скачок потенциала массивного металла только в том случае, если осадилось определенное количество последнего; при меньших количествах они давали меньшее значение соответственно меньшей концентрации. Если мы вспомним, что газы и растворенные вещества обладают упругостью растворения, зависящей от их концентрации, то это наблюдение не будет нам более казаться удивительным. [28]
Страницы: 1 2