Раствор - сульфат - церие
Cтраница 3
Другие варианты метода определения редуцирующих Сахаров включают окисление их взятым в избытке K3 [ Fe ( CN) 6 ] в щелочной среде и титрование образовавшегося K4 [ Fe ( GN) 6 ] раствором сульфата церия ( IV) [118] или сульфата цинка [119] амперометрически с двумя поляризованными электродами. [31]
При этом к образующемуся раствору Re ( V) добавляли избыток сульфата железа ( Ш); пятивалентный рений восстанавливает Fe ( III) до Fe ( II), которое затем титруют 0 01 - 0 02 N раствором сульфата церия ( 1У) в присутствии того же индикатора. [32]
Готовят раствор вещества, как указано в частной статье, подкисляют серной кислотой ( - 100 г / л) ИР и прибавляют раствор о-фенантролина ( 1 г / л) ИР; появляется интенсивное красное окрашивание, которое исчезает при добавлении раствора сульфата церия ( 35 г / л) ИР. [33]
К 5 - 10 мг восстановленного раствора прибавляют 10 мл 4N раствора серной кислоты, 2 капли 0 1 % - ного раствора индикатора, 2 5 - 3 мл 85 % - ной фосфорной кислоты, разбавляют водой до объема 60 мл и титруют 0ОШ раствором сульфата церия ( IV) до перехода бирюзово-голубой окраски индикатора в ярко-розовую и затем до полного обесцвечивания. Для достижения большей точности рекомендуется вводить индикаторную поправку, определяемую в холостом титровании. [34]
К 5 - 10 мг восстановленного раствора прибавляют 10 мл 4N раствора серной кислоты, 2 капли 0 1 % - ного раствора индикатора, 2 5 - 3 мл 85 % - ной фосфорной кислоты, разбавляют водой до объема 60 мл и титруют 0 01jV раствором сульфата церия ( IV) до перехода бирюзово-голубой окраски индикатора в ярко-розовую и затем до полного обесцвечивания. Для достижения большей точности рекомендуется вводить индикаторную поправку, определяемую в холостом титровании. [35]
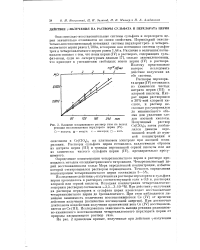 |
Влияние насыщающего раствор газа на выход реакции восстановления перхлората церия ( IV. О - водород. д-воздух. х - кислород. П - азот. [36] |
Растворы сульфата церия готовились аналогичным образом из нитрата церия ( III) и трижды перегнанной серной кислоты или же из химически чистого сульфата церия ( IV), предварительно просушенного. [37]
В качестве исходного вещества для установки титра сульфата церия можно использовать также раствор химически чистого тригидрата гексацианоферроата ( II) K4 [ Fe ( CN) 6 ] - ЗН2О ( эквивалентный вес 422 15), применение которого описано выше. Растворы сульфата церия устанавливают. КЛРе ( СМ) 6 ], применяя в качестве индикатора сетопалин - С. Как было указано выше, это титрование удобно проводить с помощью бюретки емкостью 10 -мл. [38]
Титр раствора сульфата церия может быть установлен одним из известных методов с помощью того или другого исходного вещества. [39]
Анализируемый раствор перекиси водорода разбавляют в мерной колбе емкостью 100 мл водой до метки. Титруют раствором сульфата церия ( IV) до изменения окраски из бледно-розовой в почти бесцветную. [40]
Раствор сульфата четырехвалентного церия стандартизируют также по щавелевой кислоте. Можно стандартизировать раствор сульфата церия по соли Мора, аналогично описанному на стр. [41]
Реакцию выполняют или в микропробирке, или на капельной пластинке. К капле исследуемого раствора сульфата церия ( IV) прибавляют по капле азотной кислоты и 5 % - ного спиртового раствора антраниловой кислоты или водного раствора антранилата аммония. [42]
Раствор разбавляют до 100 мл водой, добавляют 1 - 2 капли ферро-о-фенантролина ( стр. С и титруют раствором сульфата церия, следя, чтобы температура раствора не снижалась ниже 45 С. [43]
К раствору арсеиита, который должен быть подкислен до концентрации H2SO4, равной 1 М, приливают 0 5 мл 0 005 М раствора KI и 2 капли 0 001 М ( 0 25 % - ного) раствора ферроина. Титруют 0 1 М раствором сульфата церия ( IV) до появления бледно-голубой окраски в конечной точке. [44]
Хлорат-ионы в присутствии перхлорат-ионов восстанавливают до хлорид-ионов избытком соли Мора. Избыток соли Мора титруют раствором сульфата церия в присутствии фенилантранило-вой кислоты, затем раствор подщелачивают гидроксидом аммония и выпавший гидроксид железа отфильтровывают. [45]
Страницы: 1 2 3 4