Раствор - сульфат - четырехвалентное церие
Cтраница 2
После растворения навески мышьяковистого ангидрида в 15 мл 2N раствора едкого натра добавляют 20 мл концентрированной соляной кислоты. Раствор разбавляют водой до 100 мл, прибавляют 5 мл монохлорида иода, одну-две капли ферро-смренантролина и титруют раствором сульфата четырехвалентного церия, пока красно-оранжевая окраска не начнет ослабевать, но будет возникать через некоторое время после добавления окислителя. Затем раствор нагревают до 50 Сии продолжают медленно титровать до полного, исчезновения окраски, не возникающей в течение 1 мин. [16]
Описаны периметрические методы определения кобальта. Двухвалентный кобальт окисляют до трехвалентного раствором хлорного железа в присутствии фенантролина, далее эквивалентное кобальту количество ионов двухвалентного железа титруют раствором сульфата четырехвалентного церия. [17]
Разработан титриметрический метод определения шестивалентного молибдена, основанный на его количественном восстановлении небольшим избытком сульфата гидразина в среде 1 - 2 М НС1 при нагревании в течение 10 мин. После охлаждения к раствору прибавляют соляную кислоту до концентрации 4 М, затем 5 мл сиропообразной Н3РО4 ( на 50 мл раствора) и 0 5 мл 0 1 % - ного раствора ди-фенилбензидина; все титруют 0 05 N раствором сульфата четырехвалентного церия до появления фиолетового окрашивания. [18]
Разработан титриметрический метод определения шестивалентного молибдена, основанный на его количественном восстановлении небольшим избытком сульфата гидразина в среде 1 - 2 М НС1 при нагревании в течение 10 мин. После охлаждения к раствору прибавляют соляную кислоту до концентрации 4 М, затем 5 мл сиропообразной Н3РО4 ( на 50 мл раствора) и 0 5 мл 0 1 % - ного раствора ди-фенилбензидина; все титруют 0 05 JV раствором сульфата четырехвалентного церия до появления фиолетового окрашивания. [19]
При окислении двухвалентного кобальта сульфатом четырехвалентного церия поступают следующим образом. К раствору, содержащему двухвалентный кобальт ( 18 - 88 мг Со), избыток комплексона III ( 0 2 - 1 0 г) и ацетат кальция ( 1 0 - 2 0 г), прибавляют из бюретки 0 1 N раствор сульфата четырехвалентного церия, непрерывно измеряя потенциал платинового электрода. Окисление кобальта происходит с достаточной скоростью. [20]
Для определения концентрации растворов перекиси водорода, особенно в присутствии органических веществ, рекомендуется также объемный метод, основанный на восстановлении иона четырехвалентного церия. Сообщается [53], что в присутствии эфира, лишенного перекисей, этанола или смеси эфира с этанолом титрование ионом четырехвалентного церия до конечной точки, определяемой при помощи 1 10-фенап-тролинового комплекса закиспого железа или электрометрически, дает более удовлетворительные результаты, чем титрование перманганатом. Можно применять растворы сульфата четырехвалентного церия по способу, совершенно аналогичному титрованию пермапганатом, по желтая окраска в конечной точке несколько хуже различается, чем розовая от перманганата. Исследован также ряд индикаторов 55 ] для этой реакции, а именно родамин 6G и кристаллический фиолетовый 156 ]; закисножелезпый комплекс питрофенантролипа 57 обесцвечивается слабее, чем такой же комплекс с 1 10-фепаптролипом. Хурдис и Ромейн 157 ] изучили точность определения перекиси водорода путем титрования четырехвалентным церием и показали, что точность этого метода такая же, как и при абсолютном газометрическом методе или при титровании перманганатом. Эти авторы приводят подробности методики установления титра раствора церия, рассматривая этот метод также с точки зрения надежности и стоимости различных источников церия. [21]
В нашей работе обследовано отношение оксихинолинатов Ce ( III), Ce ( IV), Ti ( IV), Zr ( IV), Nb ( V), Th ( IV), Ta ( V) к органическим растворителям. Изучены спектры светопоглощения оксихинолинатов этих металлов с целью количественного определения их. Для работы были использованы лимоннокислые растворы ниобия и тантала, растворы сульфата четырехвалентного церия, нитрата трехвалентного церия, хлоридов тория, циркония, титана, содержащие 1 мг этих металлов в 1 мл. В качестве реактива был использован 2 % - ный раствор оксина в хлороформе. [22]
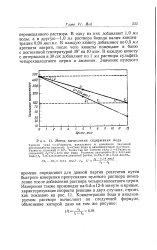 |
Метод вычисления содержания йода. [23] |
В одну из них добавляют 1 0 мл воды, а в другую-1 0 мл раствора йодида калия концентрации 0 04 мкг. В каждую кювету добавляют по 0 5 мл арсенита натрия, после чего кюветы помещают в баню с постоянной температурой 39 на 10 мин. В каждую кювету с интервалом в 30 сек добавляют по 1 мл раствора сульфата четырехвалентного церия и аммония. [24]
При титровании концентрация кислоты должна быть выше 2 Л, раствор объемом около 300 мл должен содержать не более 0 25 г Мо. В противном случае может образоваться красный осадок, не взаимодействующий с избытком сульфата четырехвалентного церия; осадок затрудняет установление конечной точки титрования. Указанный осадок образуется, когда в кислом растворе находятся одновременно трехвалентный церий, шестивалентный молибден, соединение двухвалентного железа с о-фенантролином. Поэтому к титруемому раствору пятивалентного молибдена в 2 JVHC1 прибавляют 5 - 10 мл концентрированной серной кислоты. Если необходимо, то раствор разбавляют добавлением 2 N HC1 до указанной выше концентрации молибдена. Затем прибавляют две капли 0 025 М раствора соединения двухвалентного железа с о-фенантролином и титруют при комнатной температуре раствором сульфата четырехвалентного церия. В конечной точке наблюдается очень отчетливое изменение окраски. [25]
Страницы: 1 2