Раствор - хромат - натрий
Cтраница 2
Так же как катиониты, ведут себя аниониты по отношению к анионам. Взболтаем зерна анионита с раствором хромата натрия Na2Cr04 ( вспомним, что ионы СгО42 - имеют желтую окраску) и после этого промоем водой, приливая и сливая ее до тех пор, пока вода не станет бесцветной. [16]
 |
Схема процесса обработки сточных вод, образующихся при хромировании, с помощью ионного обмена. [17] |
Из емкости 14 впрыскивается водный раствор гидро-эксида натрия, объем которого равен объему аниоиита. При этом происходит десорбция адсорбированных на анионите ионов двухромовой кислоты и образуется раствор хромата натрия. [18]
При использовании в качестве восстановителя серы применяют щелочной раствор хромата натрия. К этому раствору добавляют суспензию серы, полученную ее размолом в части раствора хромата натрия. [19]
При восстановлении элементарной серой применяют щелочной раствор монохромата натрия с содержанием - 110 г / л СгО3 и 5 - 13 г / л NaOH. В этот раствор добавляют суспензию серы, полученную путем размола серы с частью раствора хромата натрия, а затем подают его в каскад реакторов, где при температуре кипения ( 102 - 103 С) хромат восстанавливается до гидрата окиси хрома. [20]
 |
Кривая титрования ионов натрия НС1. [21] |
В процессе титрования выделяется малорастворимый хромат таллия. Хорошие результаты получены при титровании 0 01 М водного раствора сульфата таллия 0 07 М раствором хромата натрия. [22]
После повторной тщательной промывки в проточной воде физически и химически чистые алюминиевые детали могут быть подвергнуты анодированию. В противном случае во избежание потускнения их следует погрузить в ванну консервации ( 1 % - ный раствор хромата натрия), где они могут сохраняться продолжительное время ( иногда день), не теряя блеска. [23]
В пробирку с хромитом натрия, полученным в опыте 2, прибавьте 1 - 2 капли раствора щелочи и 3 - 5 капель 3 / 6-ного раствора перо-ксида - водорода. Нагрейте смесь на водяной бане или очень осторожно пламенем горелки до перехода зеленой окраски хромита в желтую, что указывает на образование в растворе хромата натрия. [24]
После прокалки производится выщелачивание водой и размол хроматного спека в шаровых мельницах мокрого помола. Выщелоченную пульпу подвергают сатурации углекислотой печных газов для сокращения потерь хрома со шламами и фильтруют, а затем промывают на барабанных вакуум-фильтрах. Раствор хромата натрия обрабатывают серной кислотой с доведением рН до 7 8 8 2 для выделения гидрата окиси алюминия. [25]
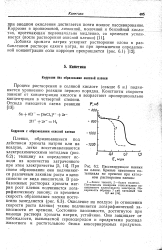 |
Пассивирующие пленки на олове. Кривые изменения потенциала во времени при катодном растворении пленок. [26] |
При своем образовании они подчиняются различным законам роста в зависимости от вида окислителя. Окисление на воздухе ( в отношении скорости роста пленки) также подчиняется логарифмической зависимости от времени. Состояние пассивности, достигнутое при помощи раствора хромата натрия, устойчиво. Оно защищает от побежалости, вызываемой сероводородом и продуктами распада животного и растительного белка консервируемых продуктов. [27]
Непроточную воду из первой промывной ванны, в которой постепенно накапливается хромовая кислота и посторонние металлы, очищают с помощью катионного обменника. Анионный обменник, обогащенный хромовой кислотой, промывают 5 - 15 % - ным раствором едкого натра. При этом хромовая кислота вначале получается в виде раствора хромата натрия, который пропускают через использованный катионный обменник для удаления металлов. [28]
Пы двух солен металлов, в результате чего попадающие в поры растворы при соединении друг с другом образуют цветное нерастворкющееся химическое соединение. Так, если оксидированное изделие опустить сна чала в раствор азотнокислого серебра, а затем в раствор хромата натрия, то в порах образуется коричневато-красный нерастворяющийся в воде хромат серебра. [29]
К противоположному заключению пришли Фрейндлих, Патчеке и Цо-хер 3), исследовавшие свойства железных зеркал, приготовленных в вакууме, до и после соприкосновения с воздухом В первом случае железо было активно, во втором случае - пассивно, причем изменение поверхности могло быть установлено оптическим путем. Тот факт, ч го в некоторых случаях на аноде образуются окисные пленки, видные и простым глазом, хорошо известен; достаточно вспомнить анодную поляризацию свинцовых электродов в серной кислоте или в растворе хромата натрия. [30]
Страницы: 1 2 3