Раствор - гидроокись - кальций
Cтраница 1
Раствор гидроокиси кальция отфильтровывают от примесей ( нерастворимых карбонатов, окислов и гидроокисей) и пропускают через него двуокись углерода, пока не прекратится выпадение осадка. Затем осадок карбоната отфильтровывают на воронке с отсосом и высушивают при 200 - 250 С. Карбонат кальция образуется также при взаимодействии растворимых солей кальция с карбонатом калия, натрия или аммония. [1]
Раствор гидроокиси кальция в воде ( известковая вода) является сильным основанием, вступает во все химические реакции, характерные для сильных оснований. Известковую воду применяют в сахарной промышленности, при дублении кож, для получения различных соединений кальция. [2]
Раствор гидроокиси кальция ИР должен быть свежеприготовленным. [3]
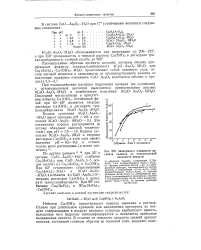 |
Зависимость влажности ар-сената кальция от относительной влажности воздуха. [4] |
При взаимодействии раствора гидроокиси кальция ( не суспензии) с ортомышьяковой кислотой выделяются прямоугольные призмы 4СаО - As2O5 - 5H2O и ромбические пластинки ЗСаО-As2Os-10Н2О. [5]
В 250 мл раствора гидроокиси кальция содержится 3 701 г Са ( ОН) 2: определите Сн и С, раствора. [6]
Через слой силикагеля пропускали раствор гидроокиси кальция со скоростью 1 мл / мин. Скорость потока гидроокиси была рассчитана по объему вытекшего раствора. [7]
При гашении жженной извести получается раствор гидроокиси кальция ( известковая вода), суспензия ( известковое молоко) или кашицеобразная масса, которая образуется после осаждения суспензии. [8]
На рисунках видно, что кривые титрования раствором гидроокиси кальция и едким натром отличаются в области между изоэлектрической точкой и точкой, расположенной по другую сторону рН 7, и что обе кривые почти идентичны в областях с более сильной щелочностью. [9]
В работе [8], посвященной изучению условий кристаллизации арсенатов кальция из растворов гидроокиси кальция и мышьяковой кислоты в интервале температур 17 - 60, получены результаты, позволившие уточнить некоторые противоречивые моменты. [10]
Детали из литейных сплавов типа АЛ2 и АЛ9 необходимо травить в растворе гидроокиси кальция ( 4 - 5 г / л) при 60 - 80 С в течение 10 - 15 мин. [11]
 |
Схема установки непрерывной инверсии нитрит-нитратных щелоков. 1 - разбрызгивающее устройство. 2 - инверсионная колонна. 3 -отду-вочная колонна. 4 - отделитель шлама. 5 -насос. [12] |
Абсорбционные колонны с решетчатыми тарелками провального типа особенно эффективны при абсорбции окислов азота раствором гидроокиси кальция. В случае абсорбции окислов азота растворами кислоты применение решетчатых тарелок менее эффективно, чем ситчатых; последние позволяют изменять скорость газа в более широком интервале, чем решетчатые. [13]
Предварительное введение кристаллов тетракальцийарсената, как и в случае реакции между мышьяковой кислотой и раствором гидроокиси кальция, вызывает исчезновение скрытого периода кристаллизации тетракальцийарсената, благодаря чему скорость образования кристаллов резко возрастает. Поэтому скорость реакции образования тетракальцийарсената опережает скорость реакции дегидратации декагидрата в дигидрат. Вероятность образования твердых растворов, таким образом, уменьшается. Поэтому введение затравки позволяет повысить температуру реакции даже до 60, несмотря на то, что устойчивость двойной соли с повышением температуры уменьшается и опасность образования гелеобразного декагидрата возрастает. [14]
Предварительное введение кристаллов тетракальцийарсената, как и в случае реакции между мышьяковой кислотой и раствором гидроокиси кальция, вызывает исчезновение скрытого периода кристаллизации тетракальцийарсената, благодаря чему скорость образования кристаллов резко возрастает. Вероятность образования твердых растворов, таким образом, уменьшается. Поэтому введение затравки позволяет повысить температуру реакции даже до 60, несмотря на то, что устойчивость двойной соли с повышением температуры уменьшается и опасность образования гелеобразного декагидрата возрастает. [15]
Страницы: 1 2 3 4