Раствор - гидроокись - натрий
Cтраница 2
Двуокись углерода абсорбируется раствором гидроокиси натрия в насадочной колонне при 20 С. [16]
Образец растворяют в растворе гидроокиси натрия и помещают в сосуд Дьюара. Раствор гипохлорита натрия ( 0 5 М) добавляют небольшими порциями, измеряя температуру через 30 сек после каждого добавления. Если построить график в координатах суммарный объем титранта - температура, то получается почти линейная зависимость. В точке эквивалентности на кривой титрования появляется изгиб. Чтобы приспособить этот метод для анализа в микромасштабе, необходимо воспользоваться термистером. [17]
В 0 1 М растворе гидроокиси натрия высоты обеих волн равны. [18]
Добавляют 20 % - ный раствор гидроокиси натрия ( - 35 мл) до тех пор, пока раствор не станет щелочным ( контролируют по лакмусовой бумаге), подкисляют несколькими каплями серной кислоты ( 1: 4), приливают 5 мл 0 5 % - ного раствора перманганата калия и кипятят. [19]
Добавляют 20 % - ный раствор гидроокиси натрия ( - - 35 мл) до тех пор, пока раствор не станет щелочным ( контролируют по лакмусовой бумаге), подкисляют несколькими каплями серной кислоты ( 1: 4), приливают 5 мл 0 5 % - ного раствора перманганата калия и кипятят. [20]
Молярную концентрацию ( нормальность) раствора гидроокиси натрия определяют титрованием отдельных масс из микробюретки при применении кислого йодноватокислого калия и из бюретки вместимостью 25 см3 при применении кислого фталево-кислого калия. [21]
Добавляют по каплям 5 М раствора гидроокиси натрия до образования осадка, слаборастворимого при нагревании. Растворяют этот осадок несколькими каплями соляной кислоты и переносят раствор в ионообменную колонку, предварительно промытую водой. Раствор пропускают через колонку со скоростью 30 - 40 мл / мин в полипропиленовый стакан емкостью 400 мл и затем промывают катионит - 200 мл воды. Добавляют 0 5мл концентрированной соляной кислоты и кипятят раствор в течение 1 мин, но не дольше ( примечание 1), для удаления углекислоты. После этого раствор охлаждают до комнатной температуры. [22]
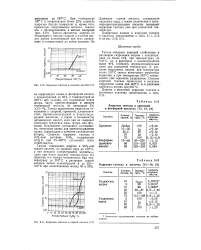 |
Коррозия тантала в соляной кислоте [ 17.| Коррозия тантала в щелочах. [23] |
Тантал обладает хорошей стойкостью к растворам гидроокиси натрия с концентрацией не более 10 % при температурах до 100 С, но в растворах с концентрациями выше 40 % стойкость неудовлетворительна даже при комнатной температуре. В расплаве гидроокиси натрия при температуре около 315 С тантал испытывает умеренную коррозию, а при температуре 535 С наблюдается уже серьезное разрушение. Сильная коррозия тантала происходит в расплаве гидроокиси калия при 360 Сив расплаве карбоната натрия при 850 С. [24]
Избыток серной кислоты определяют титрованием раствором гидроокиси натрия. [25]
Выделившуюся изотиоциановую кислоту определяют титрованием раствором гидроокиси натрия с фенолфталеином в качестве индикатора. [26]
В результате обработки смывных вод раствором гидроокиси натрия при рН 12 происходило почти полное разрушение комплексов железа, никеля, меди, что подтверждается резким: уменьшением концентраций этих металлов в воде после отделения выпавшего осадка. Доказательством разрушения комплексов является также появление в обрабатываемой воде свободного трилона Б, концентрация которого растет с повышением рН ( рисунок), в то время как концентрация железа и других тяжелых металлов снижается. [27]
Пропускают через ряд иарботеров, содержащих раствор гидроокиси натрия, а затем через барботе. Направляют алпквотную долю в перегонную колбу, подщелачивают я отгоняют аммиак в стандартную кислоту. [28]
При медленном добавлении избытка 2 М раствора гидроокиси натрия появляется зеленый осадок, который затем полностью растворяется. При добавлении к другой порции исходного раствора 0.1 М соляной кислоты выпадает белый осадок. После отфпльтровыванпл оказывается, что осадок растворим в водном аммиаке. [29]
При медленном добавлении избытка 2 М раствора гидроокиси натрия появляется зеленый осадок, который затем полностью растворяется. При добавлении к другой порции исходного раствора 0 1 М соляной кислоты выпадает белый осадок. После отфильтровывания оказывается, что осадок растворим в водном аммиаке. [30]
Страницы: 1 2 3 4