Слабосолянокислый раствор
Cтраница 2
Метод заключается в том, что при нагревании в слабосолянокислых растворах платина и палладий легко восстанавливаются каломелью до металла. [16]
Свинец количественно восстанавливается хлоридом двухвалентного хрома до металла в слабосолянокислом растворе, но скачок потенциала платинового электрода не наблюдается. Он восстанавливается также в присутствии хлорида аммония и ацетата натрия, добавляемых для удержания свинца в растворе. В среде концентрированной соляной кислоты свинец почти не восстанавливается. [17]
При содержании 0 2 % олово предварительно отделяют тионалидом из слабосолянокислого раствора. Титан удерживают в растворе в виде лимоннокислого комплекса. [18]
Ванино и Трауберт [ 13221 установили, что, если к слабосолянокислому раствору ШС1з и HgCb прибавить избыток омеги НзР02 и HaOs ( 1 капля продажной НзР02 на 1 мл 3 % ЩОг), то ртуть осаждается количественно в виде каломели, а висмут остается в растворе. К фильтрату, содержащему висмут, HaOs и НС1, добавляют NaOH до слабощелочной реакции, затем НзРОа и нагревают на голом пламени до полного просветления раствора над черным осадком. Выделившийся висмут собирают в комья при помощи стеклянной палочки. Приведенные авторами л иные показывают, что метод не дает точных результатов. [19]
При взаимодействии комплексных хлоридов платины ( II) с тионалидом в слабосолянокислом растворе образуется желтое соединение состава Pt ( Ci2Hi0ONS) 2, нерастворимое в соляной кислоте, едком натре, спирте. [20]
При взаимодействии комплексных хлоридов платины ( II) с тионалидом в слабосолянокислом растворе образуется желтое соединение состава Pt ( Ci2H 0ONS) 2, нерастворимое в соляной ислоте, едком натре, спирте. [21]
Согласно данным Лама и Мардена [14] и Лама и Симмонса [15], равновесие между розео - и пурпурео-ионами в слабосолянокислом растворе сильно смещается в сторону розео-иона. [22]
Для отделения элементов сероводородной группы, а также для восстановления хлорида железа ( III) рекомендуется1, обработка сероводородом в слабосолянокислом растворе, однако этот метод нам кажется малонадежным вследствие возможного окисления сульфид-ионов. [23]
Затем были поставлены опыты по отделению железа, алюминия и хрома от марганца, кобальта и никеля в следующих условиях: слабосолянокислый раствор солей указанных металлов после прибавления хлористого аммония нагревали до кипения, и полуторные окислы осаждали 20 % - ным раствором пиридина. [24]
Для отделения элементов сероводородной группы, а также для восстановления хлорида железа ( III) рекомендуется а, обработка сероводородом в слабосолянокислом растворе, однако этот метод нам кажется малонадежным вследствие возможного окисления сульфид-ионов. [25]
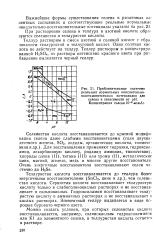 |
Приблизительные значения реальных нормальных окислительно-восстановительных потенциалов для. [26] |
Теллуристая кислота восстанавливается до теллура более энергичными восстановителями ( SnCl2, цинк и др.), чем селенистая кислота. Сернистая кислота восстанавливает теллуристую кислоту только в слабосолянокислых растворах и не восстанавливает в сильнокислых. Гидроксиламин восстанавливает теллуристую кислоту в аммиачных растворах и не восстанавливает в кислых растворах. Элементный теллур выделяется в виде порошка буровато-черного цвета. [27]
Кроме того, Стоун нашел, что сульфид висмута, осажденный из слабосолянокислого раствора сероводородом, не растворяется или растворяется очень мало в избытке сульфида калия при кипячении. [28]
Хорошо высушенную ( на воздушной бане) смесь сульфидов висмута и кадмия, полученных пропусканием сероводорода в кипящий слабосолянокислый раствор, помещают в фарфоровой лодочке в высушенную тугоплавкую стеклян-иую трубку и пропускают в нее из газометра воздух, прошедший через склянку с бромом. Реакция начинается уже при комнатной температуре, но для ее ускорения трубку подогревают. Слишком сильного нагревания нужно избегать. Через полчаса весь висмут в виде бромида переходит в приемник с разбавленной соляной кислотой, а весь кадмий в виде бромида остается в лодочке. [29]
Классический метод отделения заключается в отгонке четырехоки-сей рутения и осмия из нагретого до кипения щелочного раствора руте-неата и осмеата, через который пропускается ток хлора. В настоящее время этот метод вытеснен вариантом броматного метода Джилкриста, который основан на том, что при дистилляции слабосолянокислого раствора платиновых металлов с избытком бромата натрия отгоняются только четырехокиси рутения и осмия. По этому варианту метода отгоняющиеся пары пропускают сначала через разбавленную соляную кислоту для переведения четырехокиси рутения в хлорид, а затем через спиртовый раствор едкого натра, переводящий четырехокись осмия в осмеат натрия. [30]
Страницы: 1 2 3