Титрованный раствор - комплексон
Cтраница 2
Как указывалось, комплексометрическое определение основано на практически мгновенном образовании незначительно диссоциированных комплексов различных катионов с титрованным раствором комплексона. Хотя принцип образования комплексных соединений был обстоятельно рассмотрен в теоретической части, однако не мешает привести его здесь в общих чертах. [16]
Чувствительность цветной реакции, как отмечалось, значительна, и поэтому оказывается возможным проводить микроопределения с очень разбавленными титрованными растворами комплексона. [17]
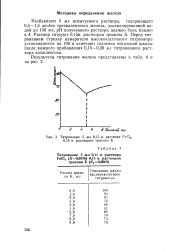 |
Титрование 5 мл 0 15 н. раствора FeCI, 0 15 н. раствором трилона Б. [18] |
Перед титрованием стрелку измерителя высокочастотного титрометра устанавливают на 100 и отмечают значения показаний шкалы после каждого прибавления 0 10 - 0 30 мл титрованного раствора комплексона. [19]
Для проведения отдельных определений к нейтральному анализируемому раствору прибавляют достаточное количество буферного раствора или едкого натра, немного твердого индикатора и титруют из микробюретки 0 01 или 0 001 М титрованным раствором комплексона. Кислые растворы перед определением нейтрализуют разбавленным раствором аммиака в присутствии настолько малого количества метилового красного, чтобы только был виден переход окраски. [20]
К 50 мл анализируемого легкого сока прибавляют 100 мл смеси спирта с ацетоном ( 1: 1), приливают 10 мл буферного раствора, вводят 6 капель эриохрома черного Т и титруют титрованным раствором комплексона до появления синей окраски. [21]
Титрованные растворы комплексонов используют для количественного определения катионов и анионов. Анионы определяют косвенным методом. Анион осаждают в виде труднорастворимой соли и определяют по количеству связанного с ним катиона. Это обстоятельство позволяет определять одни катионы в присутствии других. [22]
Указанный принцип титрования был подробно изучен Швар-ценбахом и его школой. В зависимости от рН титрованного раствора комплексона следует установитьрНтитруемого раствора по взятому индикатору, подбор которых для титрования того или иного катиона дается Шварценбахом в обзорных таблицах. [23]
Пробу воды, пропущенную через катионит в Н - форм. Избыток ионоа бария определяется комплексонометрическим титрованием титрованным раствором комплексона III в аммиачной среде с применением крезолфталексона в качестве индикатора. Обратным титрованием раствором хлорида бария определяют точку эквивалентности. [24]
Незначительный избыток никелевых ионов связывают добавлением капли титрованного раствора комплексона. [25]
К раствору о осадком СаМоО4 при рН 10 прибавляют некоторое количество цианида калия для маскировки следов тяжелых металлов, избыток ионов кальция связывают добавлением комплексона III, причем в качестве индикатора служит эриохро мчерный Т вместе с комплексонатом магния. Осадок СаМоО4 растворяют затем добавлением измеренного избытка титрованного раствора комплексона III при нагревании и избыток комплексона III оттитровывают стандартизированным раствором соли магния. Израсходованное количество комплексона III соответствует количеству кальция и, следовательно, молибдена. [26]
К раствору о осадком СаМоО4 при рН 10 прибавляют некоторое количество цианида калия для маскировки следов тяжелых металлов, избыток ионов кальция связывают добавлением комплексона III, причем в качестве индикатора служит эриохромчерный Т вместе с комплексонатом магния. Осадок СаМоО4 растворяют затем добавлением измеренного избытка титрованного раствора комплексона III при нагревании и избыток комплексона III оттитровывают стандартизированным раствором соли магния. Израсходованное количество комплексона III соответствует количеству кальция и, следовательно, молибдена. [27]
По этому методу фосфор осаждают в виде фосфоромолибдата, осадок растворяют в аммиаке, нейтрализуют серной кислотой, Movl восстанавливают металлическим висмутом4 и титруют ванадатом аммония, применяя фенилантраниловую кислоту в качестве индикатора. Осадок растворяют в соляной кислоте, добавляют небольшой избыток титрованного раствора комплексона III, нейтрализуют едким натром и титруют избыток комплексона III раствором сульфата магния. [28]
Сульфаты можно определять комплексометрически косвенным путем. Сначала осаждают сульфат-ионы солью бария, а затем избыток ионов определяют титрованным раствором комплексона ( стр. [29]
Неясный переход окраски индикатора происходит вследствие присутствия металлов, комплексы которых с примененным индикатором более прочны, чем с комплексоном III. Другие катионы, как, например, свинец, кадмий, марганец, цинк, барий и стронций, титруются вместе с кальцием и магнием и повышают этим расход титрованного раствора комплексона III. Для устранения мешающих влияний при титровании и для связывания некоторых катионов, вызывающих повышенный расход раствора, можно применить цианид калия, гидроксиламин солянокислый или сульфид натрия, которые прибавляют к титруемому раствору. [30]
Страницы: 1 2 3