Неизвестный раствор
Cтраница 2
Определение нормальности неизвестного раствора с помощью титрованного раствора называют титрованием. [16]
Определение концентрации неизвестного раствора на этих приборах ведут следующим образом. Сначала обе кюветы заполняют растворителем ( или контрольным раствором) и устанавливают в гнезда фотоколориметра. Ставят необходимый для измерения светофильтр и включают освещение. При помощи диафрагм ( или других специальных приспособлений) уравнивают фототоки приведением стрелки гальманометра к нулю, после чего фотоколориметр готов к работе. Затем правую кювету заполняют исследуемым раствором, устанавливают в гнездо и снова приводят стрелку гальванометра к нулевому положению. По показаниям шкалы-компенсатора отмечают оптическую плотность и по калибровочной кривой вычисляют содержание искомого вещества в анализируемом растворе. [17]
При анализе совершенно неизвестного раствора зачастую приходится затрачивать много времени, чтобы оттитровать раствор сразу точно до точки эквивалентности. Рекомендуется сначала провести грубое, ориентировочное титрование или в случае перетитрования раствора оттитровывать избыточный дитизон титрованным раствором соли металла. Часто путем подкисления объединенного органического экстракта можно вновь перевести металл в ионное состояние и повторить титрование. [18]
Таким образом, неизвестный раствор становится связующим белой краски. Мы обнаруживаем, что изменение спектрального пропускания этой белой красочной пленки с длиной волны вполне поддается измерению. [19]
Если студенту нужен неизвестный раствор, то он приносит чистую, сухую калибрированную капиллярную или центрифужную пипетку преподавателю, который отмеривает требуемый объем раствора. [20]
Если при полярографировании неизвестного раствора вместо волны получается непрерывно возрастающая прямая или кривая ( рис. 183 г), это значит, что фон для раствора выбран неудачно и необходимо заменить раствор. Если колебание зеркальца гальванометра неравномерное ( рис. 183, д), необходимо обратить внимание на работу капилляра. Когда капли образуются неравномерно или очень мелкими, - капилляр засорен и его надо сменить. Если полярограмма получается возрастающей с самого начала движения контакта реохорда ( рис. 183, е), это значит, что в растворе имеется кислород или какая-то другая примесь; в этом случае необходимо сменить раствор и тщательно удалить кислород. Если полярограмма получается нормальной ( рис. 183, б), можно приступить к анализу. [21]
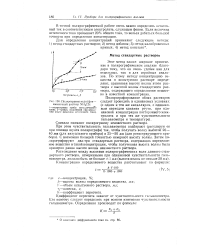 |
Подпрограмма меди ( фон - аммиачный раствор NH4C1. [22] |
Сначала снимают полярограмму неизвестного раствора. С возможно большей точностью измеряют высоту волны. Затем по-лярографируют два-три стандартных раствора, содержащих определяемое вещество в такой концентрации, чтобы полученная высота волны была примерно равна высоте волны неизвестного раствора. [23]
Сначала снимают полярограмму неизвестного раствора. С возможно большей точностью измеряют высоту волны. Затем полярографируют стандартный раствор, содержащий определяемое вещество ( медь) в такой же приблизительно концентрации, чтобы полученная высота волны была примерно равна высоте волны неизвестного раствора. Высота полярографической волны стандартного раствора должна быть не меньше 20 мм. [24]
Определяют кривую экстинкций неизвестного раствора; наносят, на тот же самый график зависимости ( Ell) от длин волн. [25]
Для измерения рН неизвестного раствора сурьмяным электродом определяют потенциал сурьмяного электрода в этом растворе. Затем по калибровочной кривой находят, какому значению рН соответствует полученное значение потенциала. Поскольку сурьмяный электрод не вполне подчиняется уравнению Нернста, на калибровочном графике получится е прямая линия, а кривая и поэтому ответ будет тем точнее, чем ближе были взяты значения рН при построении калибровочной кривой. Но все же ответы будут не вполне точны. [26]
Для открытия в неизвестных растворах азотной кислоты или солей азотной кислоты часто применяют такую пробу. [27]
Для определения удельной электропроводности неизвестного раствора применяют способ относительного измерения. [28]
V - объем пробы неизвестного раствора; Е - грамм-эквивалент искомого вещества. Приведенные формулы позволяют Проводить все расчеты без поправок на нормальность, так как принимается, что она может быть выражена любым целым или дробным числом. Главное во всяком расчете найти количество эквивалентов, при умножении которых на величину грамм-эквивалента всегда получится количество искомого вещества. [29]
Для определения удельной электропроводности неизвестного раствора применяют способ относительного измерения. [30]
Страницы: 1 2 3 4